��Ŀ����
����Ŀ������ʱ������һ��c(H2A)��c(HA��)��c(A2��)��0.10mol��L��1��H2A��NaOH�Ļ����Һ����Һ�в����������ʵ���Ũ����pH�ı仯������ͼ��ʾ������˵������ȷ���ǣ� ��
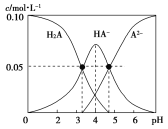
A.��c(Na��)��0.10mol��L��1����Һ�У�c(A2��)��c(H��)��c(H2A)��c(OH��)
B.pH��4����Һ�У�c(HA��)��c(H2A)��c(A2��)
C.pH��7����Һ�У�c(Na��)��c(A2��)��c(HA��)
D.Ka1(H2A)��������Ϊ10��5
���𰸡�A
��������
A. ���������غ㣬 c(Na��)��0.10mol��L��1����Һ��������Na HA�����������غ�c(A2��)��c(H��)��c(H2A)��c(OH��)����A��ȷ��
B. c(H2A)��c(HA��)��c(A2��)��0.10mol��L��1������ͼʾ��pH��4����Һ�У�c(HA��)����0.05mol��L��1������c(H2A)��c(A2��)С��0.05 mol��L��1����B����
C. ���ݵ���غ�c(Na��)+ c(H��)��2c(A2��)��c(HA��)+ c(OH��)������pH��7����Һ��c(Na��)��2c(A2��)��c(HA��)����C����
D.����ͼ��c(H2A)=c(HA��)ʱ��pH=3.3�� Ka1(H2A)=10-3.3��������Ϊ10��4����D����
�ʴ�ѡA��

 â���̸����������������ϵ�д�
â���̸����������������ϵ�д�����Ŀ���±��е�ʵ������ܴﵽʵ��Ŀ�Ļ��ܵó���Ӧ���۵���![]()
ѡ�� | ʵ����� | ʵ��Ŀ�Ļ���� |
A | ��һ��Ũ�ȵ� |
|
B | ȡ���� | ���� |
C | ��ij��Һ�еμ� | ˵��ԭ��Һ��һ������ |
D | ������ | ��ȥ |
A.A


