题目内容
【题目】NA是阿伏伽德罗常数的值。下列说法错误的是( )
A.常温常压下,40gSO3含原子总数为2NA
B.1mol铜锌合金与足量稀硝酸反应转移电子数为2NA
C.1L1molL-1CH3COONH4中性溶液含NH4+数目为NA
D.1mol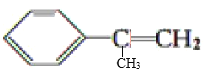 分子中最多共平面的碳原子数为9NA
分子中最多共平面的碳原子数为9NA
【答案】C
【解析】
A.n(SO3)=0.5mol,0.5mol SO3含S、O原子总物质的量为=0.5mol+0.5mol×2=2mol,总数为2NA,故A正确;
B.Zn-2e-=Zn2+,Cu-2e- = Cu2+,1mol铜锌合金转移电子的物质的量为2mol,数目为2NA,故B正确;
C.CH3COONH4水解,溶液中n(NH4+)<1mol,则溶液含NH4+数目小于NA,故C错误;
D.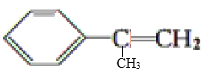 分子中苯环、乙烯基可能共平面,故所有碳原子与苯环共平面,则1mol该有机物中共面的碳原子数为9NA,故D正确;
分子中苯环、乙烯基可能共平面,故所有碳原子与苯环共平面,则1mol该有机物中共面的碳原子数为9NA,故D正确;

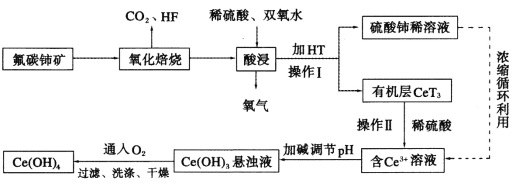
【题目】CuAlO2是重要化工品,(NH4)2Fe(SO4)2·6H2O(摩尔盐)是化学上常用的分析试剂。某小组以黄铜矿(主要成分是CuFeS2,含少量SiO2)为原料制备这两种化工品,流程如图:
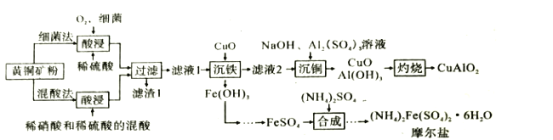
已知:①几种氢氧化物的开始沉淀和完全沉淀的pH,如表所示。
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀/pH | 4.7 | 7.6 | 2.7 |
完全沉淀/pH | 6.7 | 9.6 | 3.7 |
②4CuO+4Al(OH)3![]() 4CuAlO2+6H2O+O2↑
4CuAlO2+6H2O+O2↑
回答下列问题:
(1)CuAlO2中铜的化合价为__;滤渣1的主要成分是__(填化学式)。
(2)反应物中铁元素被氧化的目的是__。
(3)提高这两种方案中“酸浸”反应速率都需要加热,但温度都不宜过高,其原因是__。
(4)在混酸法中,CuFeS2溶于混酸生成Cu2+,Fe3+,SO42-和一种无色气体,该气体遇空气迅速变为红棕色。写出CuFeS2与混酸反应的离子方程式__。
(5)评价上述流程,补充完整:
优点 | 缺点 | |
细菌法 | ①__ | 化学反应慢,需要时间长 |
混酸法 | 节省时间 | ②___ |