题目内容
【题目】氢气既是一种清洁能源,又是一种化工原料,在国民经济中发挥着重要的作用。
(1)氢气是制备二甲醚的原料之一,可通过以下途径制取:
Ⅰ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H
Ⅱ.2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) △H
已知:①CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=akJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2=bkJmol-1
③CH3OCH3(g)+H2O(g)2CH3OH(g) △H3=ckJmol-1
则反应Ⅱ的△H____kJmol-1
(2)氢气也可以和CO2在催化剂(如Cu/ZnO)作用下直接生成CH3OH,方程式如下CO2(g)+3H2(g)CH3OH(g)+H2O(g),现将1molCO2(g)和3molH2(g)充入2L刚性容器中发生反应,相同时间段内测得CH3OH的体积分数φ (CH3OH)与温度(T)的关系如图所示:
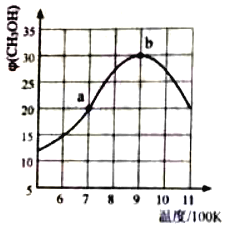
①经过10min达到a点,此时CH3OH的体积分数为20%.则v(H2)=___(保留三位小数)。
②b点时,CH3OH的体积分数最大的原因是___。
③b点时,容器内平衡压强为 P0,CH3OH的体积分数为30%,则反应的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×体积分数)
④a点和b点的v逆,a__b(填“>”“<”或”=”)若在900K时,向此刚性容器中再充入等物质的量的CH3OH和H2O,达平衡后φ(CH3OH)___30%。
⑤在900K及以后,下列措施能提高甲醇产率的是____(填字母)
a.充入氦气 b.分离出H2O c.升温 d.改变催化剂
(3)H2还可以还原NO消除污染,反应为2NO(g)+2H2(g)N2(g)+2H2O(g),该反应速率表达式v=kc2(NO)c(H2)(k是速率常数,只与温度有关),上述反应分两步进行:
i.2NO(g)+H2(g)N2(g)+H2O2(g)△H1;ii.H2O2(g)+H2(g)2H2O(g)△H2化学总反应分多步进行,反应较慢的一步控制总反应速率,上述两步反应中,正反应的活化能较低的是___(填“i”或“ii”)
【答案】(2a+2b-c) 0.086mol/(Lmin) 反应达到平衡状态 ![]() < > b ii
< > b ii
【解析】
(1)已知:①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=akJmol-1,②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol-1,③CH3OCH3(g)+H2O(g)2CH3OH(g)△H3=ckJmol-1,盖斯定律计算(①+②)×2-③得到反应Ⅱ2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)的△H;
(2)①CO2(g)+3H2(g)CH3OH(g)+H2O(g),现将1 mol CO2(g)和3mol H2(g)充入2L刚性容器中发生反应,经过10min达到a点,此时CH3OH的体积分数为20%.结合三行计算列式计算;
②b点时,CH3OH的体积分数最大的原因是此点反应达到平衡状态;
③b点时,容器内平衡压强为 P0,CH3OH的体积分数为30%,三行计算列式计算平衡物质的量,用平衡分压代替平衡浓度计算,分压=总压×体积分数;
④a点v正>v逆,b点v正=v逆,温度升高反应速率增大,若在900K时,向此刚性容器中再充入等物质的量的CH3OH和H2O,相当于总压增大平衡正向进行;
⑤在900K及以后,能提高甲醇产率的是改变条件平衡正向进行;
(3)反应为2NO(g)+2H2(g)N2(g)+2H2O(g),该反应速率表达式v=kc2(NO)c(H2),反应速率是由第一步决定,反应活化能大。
(1)已知:①CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=akJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2=bkJmol-1
③CH3OCH3(g)+H2O(g)2CH3OH(g) △H3=ckJmol-1
盖斯定律计算(①+②)×2-③得到反应Ⅱ2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)△H=(2a+2b-c)KJ/mol,故答案为:(2a+2b-c);
(2)①CO2(g)+3H2(g)CH3OH(g)+H2O(g),现将1molCO2(g)和3molH2(g)充入2L刚性容器中发生反应,经过10min达到a点,此时CH3OH的体积分数为20%。结合三行计算列式计算,设消耗二氧化碳物质的量为x,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量(mol)1 3 0 0
变化量(mol)x 3x x x
平衡量(mol)1-x 3-3x x x
CH3OH的体积分数=![]() =20%,x=
=20%,x=![]() mol,
mol,
v(H2)=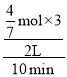 =0.086mol/(Lmin),故答案为:0.086mol/(Lmin);
=0.086mol/(Lmin),故答案为:0.086mol/(Lmin);
②b点时,CH3OH的体积分数最大的原因是反应达到平衡状态,故答案为:反应达到平衡状态;
③b点时,容器内平衡压强为P0,CH3OH的体积分数为30%,消耗二氧化碳物质的量y,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol)y 3y y y
平衡量(mol)1-y 3-3y y y
![]() =0.3,y=0.75mol,平衡状态气体总物质的量=4mol-2×0.75mol=2.5mol,反应的平衡常数
=0.3,y=0.75mol,平衡状态气体总物质的量=4mol-2×0.75mol=2.5mol,反应的平衡常数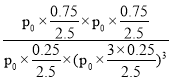 =
=![]() ,故答案为:
,故答案为:![]() ;
;
④a点v正>v逆,b点v正=v逆,温度升高反应速率增大,a点和b点的v逆,a<b,若在900K时,向此刚性容器中再充入等物质的量的CH3OH和H2O,相当于增大总压,平衡正向进行,达平衡后φ(CH3OH)>30%,故答案为:<;>;
⑤在900K及以后,能提高甲醇产率的是平衡正向进行,
a.充入氦气 总压增大分压不变,平衡不变,故a错误;
b.分离出H2O,平衡正向进行,甲醇产率增大,故b正确;
c.图中分析升温甲醇体积分数减小,说明正反应为放热反应,反应升温 平衡逆向进行,甲醇产率减小,故c错误;
d.改变催化剂,不改变化学平衡,甲醇产率不变,故d错误;
故答案为:b;
(3)H2还可以还原NO消除污染,反应为2NO(g)+2H2(g)N2(g)+2H2O(g),该反应速率表达式v=kc2(NO)c(H2)(k是速率常数,只与温度有关),上述反应分两步进行:i.2NO(g)+H2(g)N2(g)+H2O2(g)△H1;ii.H2O2(g)+H2(g)2H2O(g)△H2化学总反应分多步进行,反应较慢的一步i反应控制总反应速率,反应活化能大,正反应的活化能较低的是ii,故答案为:ii。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案