题目内容
【题目】氢气是重要的化工原料。
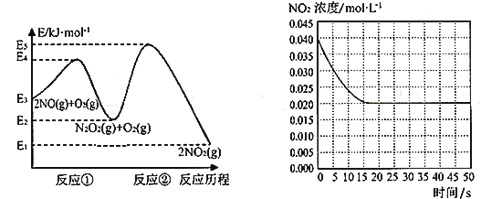
(1)利用H2S制备H2.已如:在较低温度下发生下列反应:
①H2S(g)+H2SO4(aq)═S(s)+SO2(g)+2H2O(1) △H1=+61kJmol-1
②SO2(g)+I2(s)+2H2O(1)═2HI(aq)+H2SO4(aq) △H2=-151kJmol-1
③2HI(aq)H2(g)+I2(s) △H3=+110kJmol-1
④H2S(g) H2(g)+S(s) △H4=__kJmol-1。
(2)乙烯是合成食品外包装材料一聚乙烯的单体。工业上利用H2和CO2可以制备乙烯,2CO2(g)+6H2(l)C2H4(g)+4H2O(g) △H
①在2L恒容密闭容器中投入4molCO2和amolH2,在某催化剂作用下发生上述反应,CO2的转化率与温度关系如图1所示。
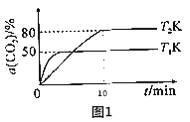
由图1判断,T2__T1(填“>”、“<”或“=”);T2K下,0~10min内H2的平均反应速率v(H2)=__molL-1min-1。
②测得单位时间内C2H4产率与温度、投料比![]() 关系如图2所示。
关系如图2所示。
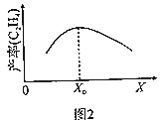
若X为温度,当温度高于X0时,单位时间内乙烯产率降低的原因可能是__。
若X为投料比,当![]() 大于X0时,乙烯产率降低的原因可能是__。
大于X0时,乙烯产率降低的原因可能是__。
③在某温度下达到平衡后,在t0时只改变一个外界条件,反应速率(v)与时间(t)的关系如图3所示。改变的条件可能是___(填字母)。

A.增大反应物浓度
B.增大压强
C.升高温度
D.加入高效催化剂
(3)科学家已研究出生物酶,利用原电池原理在常温和生物酶作用下N2和H2合成NH3,即H2在负极上发生氧化反应,H+通过质子交换膜迁移到正极区,正极上合成NH3。正极的电极反应式为__。
【答案】+20 < 0.48 B 催化剂活性降低 H2和C2H4发生加成反应 N2+6e-+6H+=2NH3
【解析】
(1)根据盖斯定律计算;
(2)①根据“先拐先平数值大”判断,根据图像知道T2下CO2的转化率,利用二氧化碳和氢气的计量数之比,计算出v(H2)=![]() ;
;
②若X代表温度,考虑催化剂的活性,若X代表投料比,考虑氢气与乙烯发生反应;
③图像上可以得到正反应速率大于逆反应速率,是突然增大的因素,不是浓度的影响;
(3)H+向正极移动,正极上是氮气得电子生成氨气,写出电极反应式;
(1)根据盖斯定律,①+②+③=④,可得ΔH4=+20kJ/mol;
(2)由图①可知,T1先达到平衡,说明温度较高,即T1>T2。由平衡转化率可知,温度越低,CO2的平衡转化率较高,说明正反应是放热反应。根据氢气的二氧化碳的计量数之比可知,氢气的速率是二氧化碳速率的三倍,故v(H2)=![]() =
=![]() =0.48mol/L;
=0.48mol/L;
由图②可知,高于X0时,产率降低,单位时间内产率实际反映速率大小,若X代表温度,可能是温度过高,催化剂失去活性;若X代表投料比,投料比高于X0,可能是H2和乙烯发生加成反应。
③改变条件,正逆反应速率都增大,(速率离开原平衡),平衡向正反应速率移动。
A.增大反应物浓度,正反应速率增大,逆反应速率不变,随后逆反应速率增大,正反应速率减小,改变条件瞬时,逆反应速率与原平衡点连接(不离开原平衡),与图像不符,故A错误;
B.增大压强,正逆反应速率都增大,正反应的计量数大于逆反应,平衡向正方向移动;
C.该可逆反应的正反应是放热反应,升高温度,平衡向逆反应方向移动,即升高温度,正逆反应速率都增大,逆反应方向速率增大程度大于正反应,与图像不符;
D.加入高效催化剂,只能缩短达到平衡的时间,平衡不移动,与图像不符;
答案选B。
(3)依题意,负极区H+向正极区迁移,正极反应式为N2+6e-+6H+=2NH3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
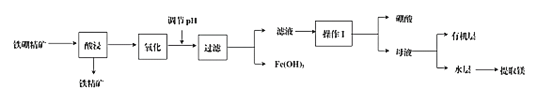
小学生10分钟应用题系列答案【题目】硼及其化合物在工业、医药、农业等部门有许多用途。某工厂以铁硼精矿(主要成分为B2O3·2MgO,还有SiO2、CaO、FeO等杂质)制取制硼酸、金属镁的工艺流程图为:
已知:硼酸在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g/100g水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
回答下列问题:
(1)使用盐酸酸浸,过程中主要反应的化学方程式为_________,为提高浸出速率,可采取的措施有_________(写出两条)。
(2)酸浸时,温度与硼浸出率的关系如图所示,则合适的酸浸温度为_________。

(3)浸出液“氧化”的是将溶液中的Fe2+用_______试剂氧化为Fe3+,反应的离子方程式为_________。
(4)从滤液中获得H3BO3晶体的“操作I”具体操作是_________。
(5)向滤液中加入有机萃取剂萃取分液,此时硼酸处于_________层中(填“有机”或“无机”)。实验室模拟萃取操作使用的玻璃仪器除烧杯外,另一主要玻璃仪器是_________。
(6)某工厂用 m1 kg的铁硼精矿制备硼酸,得到纯度为99.8%的硼酸m2 kg,则铁硼精矿中硼的质量分数是__________(列式表达)。