题目内容
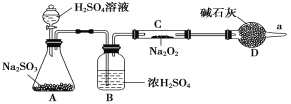
【题目】某厂废水中含5.00×10-3 mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:

(1)第①步反应的离子方程式是__________________________________________。
(2)第②步中用pH试纸测定溶液pH的操作是________________________________。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有_____________________。
(4)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需要加入________g FeSO4·7H2O。
(5)FeSO4·7H2O晶体制备步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50 ℃~80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
①反应时铁屑过量的目的是(用离子方程式表示) ________________________。
②溶液趁热过滤的原因是___________________________________________。
【答案】Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照 Fe(OH)3、Fe(OH)2 13.9 Fe+2Fe3+=3Fe2+ 减少FeSO4的损失;防止空气进入试管将Fe2+氧化为Fe3+
【解析】
废水中的Cr2O72-具有氧化性,在酸性条件下,与FeSO4·7H2O发生氧化还原反应生成含有Fe3+和Cr3+溶液,根据得到磁性材料Fe的化合价依次为+3、+2,因此加入的FeSO4·7H2O需要过量,形成含有Fe2+ 、Fe3+ 、Cr3+、SO42-的溶液,通过加入NaOH调节溶液的pH值用pH试纸测定溶液pH为9,在碱性条件下使Fe2+ 、Fe3+ 、Cr3+完全转化为Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀,通过过滤操作与SO42-分离,最后对Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀洗涤、干燥、焙烧,最终制得磁性材料Cr0.5Fe1.5FeO4。
(1)Cr2O72有较强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O72在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据得失电子、原子守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)用pH试纸测定溶液pH的操作是将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(3)由题给框图之二可得:Fe2+过量,加NaOH时,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物,故答案为:Fe(OH)3、Fe(OH)2;
(4)1L废水中含n(Cr2O72-)=5.00×103mol,根据Cr原子、Fe原子守恒,可得:Cr2O72-4Cr0.5Fe1.5FeO410FeSO4·7H2O,所以理论上n(FeSO47H2O)=10n(Cr2O72-)=5.00×103mol×10=0.05mol,所以m(FeSO47H2O)=0.05mol×278g/mol=13.9g;
(5)①铁粉过量是防止亚铁离子被氧化,铁和铁离子反应重新生成亚铁离子,反应的离子方程式为:Fe+2Fe3+=3Fe2+;
②一般物质的溶解度随温度的升高而增大,因此热溶液趁热过滤可减少硫酸亚铁晶体析出,从而减小FeSO4的损失。

【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%