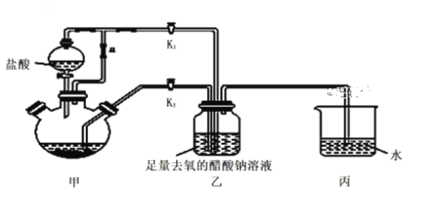
题目内容
【题目】下列氧化还原反应所标出的电子转移情况中没有错误的是( )
A.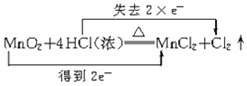 +2H2O
+2H2O
B.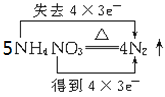 +2HNO3+9H2O
+2HNO3+9H2O
C.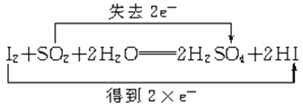
D.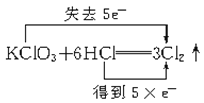 +3H2O+KCl
+3H2O+KCl
【答案】A
【解析】
A.Mn元素的化合价由+4降低为+2价,得到2e-,Cl元素的化合价由-1升高为0价,失去2e-,故A正确;
B.硝酸铵中铵根的N元素的化合价由-3升高为0价,失去5×3e-,硝酸铵中硝酸根的N元素的化合价由+5降低为0,得到3×5e-,故B错误;
C.I元素的化合价由0降低为-1价,得到2e-,S元素的化合价由+4升高为+6,失去2e-,不是O元素失电子,故C错误;
D.氯酸钾中的Cl元素的化合价由+5降低为0价,得到5e-,HCl中Cl元素的化合价由-1升高为0价,失去5×e-,故D错误;
故选A。

 智慧小复习系列答案
智慧小复习系列答案【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。