题目内容
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
【答案】A
【解析】1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合溶液的pH=4.3,溶液显酸性,加入醋酸后,溶液酸性增强,加入醋酸钠,溶液的酸性减弱。A.该温度下,1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合溶液的pH=4.3,醋酸的电离平衡常数Ka=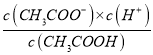 =
=![]() ≈
≈![]() =
=![]() ,故A错误;B. a点溶液的pH=3.1,是加入的醋酸后的结果,根据电荷守恒知,c(CH3COO-)>c(Na+),醋酸的电离程度较小,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;C. a以醋酸的电离为主,抑制水的电离,酸性越强,水的电离程度越小,b点加入醋酸水的电离程度减小,c点加入醋酸钠,水的电离程度增大,故水的电离程度c>b>a,故C正确;D. 当混合溶液呈中性时,c(H+)=c(OH-),根据电荷守恒有c(Na+)=c(CH3COO-),则c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D正确;故选A。
,故A错误;B. a点溶液的pH=3.1,是加入的醋酸后的结果,根据电荷守恒知,c(CH3COO-)>c(Na+),醋酸的电离程度较小,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;C. a以醋酸的电离为主,抑制水的电离,酸性越强,水的电离程度越小,b点加入醋酸水的电离程度减小,c点加入醋酸钠,水的电离程度增大,故水的电离程度c>b>a,故C正确;D. 当混合溶液呈中性时,c(H+)=c(OH-),根据电荷守恒有c(Na+)=c(CH3COO-),则c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D正确;故选A。

【题目】根据所学知识完成题目:
(1)根据氧化还原反应2H2+O2═2H2O,设计成燃料电池,负极通的气体应是 , 正极通的气体应是 .
(2)根据选择电解质溶液的不同,填写下表:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应式 |
|
|
正极反应式 |
|
|
溶液的pH变化 |
|
|
(3)若把H2改为CH4 , KOH作电解质,则负极反应式为 .
