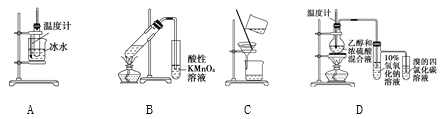
题目内容
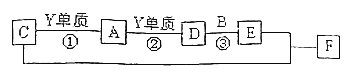
【题目】已知合金A由两种常见的金属组成。为测定其组成,某同学的实验流程如图所示:

请回答:
(1)合金A中的两种金属为_____(填化学式)。
(2)过程②中分离C和E的化学实验基本操作是________。
(3)溶液H中所含的阳离子有_____(用离子符号表示)。
(4)为测定合金的组成,若需要称量沉淀F的质量,则F需要洗涤,证明沉淀F洗涤干净的方法是_____________________。
(5)写出②③及由溶液H和氨水反应生成白色沉淀的离子方程式(没有离子方程式的写化学方程式):
过程②___________________;
______________________;
_______________________。
过程③_______________。
溶液H与氨水:_________________。
【答案】Fe Al 过滤 Al3+ H+ 取最后一次洗涤液,先加稀HNO3,再加AgNO3,若无白色沉淀,则已洗净 Fe2++2OH-=== Fe(OH)2 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Al3++4OH-===AlO2-+2H2O AlO2-+H++H2O === Al(OH)3↓ Al3++3NH3·H2O===Al(OH)3↓+3NH4+
【解析】
已知合金A由两种常见金属组成,加入过量盐酸反应得到溶液B,加入过量氢氧化钠溶液并通入空气,过滤得到红褐色沉淀,判断为Fe(OH)3,加热分解得到粉末状固体D为氧化铁,则确定原来金属含有Fe;
滤液E加入少量盐酸生成白色沉淀F和溶液G,白色沉淀F加入过量盐酸溶解得到溶液H,溶液H加入过量氨水又生成白色沉淀F,确定白色沉淀F为氢氧化铝沉淀,溶液H为过量盐酸和AlCl3溶液,溶液G为偏铝酸钠和氯化钠的混合溶液,溶液E为NaAlO2溶液,溶液B为氯化亚铁和氯化铝的混合溶液;由以上分析,合金A中金属为Fe,Al,据此分析回答问题。
(1) 由上述分析可知,合金中含Al、Fe,
故答案为:Fe;A
(2)过程②中分离 C 和 E 的化学实验基本操作是过滤,分离不溶性固体与溶液,
故答案为:过滤;
(3)溶液 H 中所含的阳离子有Al3+、H+;
故答案为:Al3+、H+;
(4)证明沉淀 F 是否洗涤干净的方法为取最后一次洗涤液少量于试管中,加硝酸酸化的硝酸银,无白色沉淀生成,说明洗涤干净,
故答案为:取最后一次洗涤液,先加稀HNO3,再加AgNO3,若无白色沉淀,则已洗净;
(5)过程②发生反应:![]() ,
,![]() ,
,![]() ,过程③发生反应:
,过程③发生反应:![]() ,溶液H与氨水发生反应:
,溶液H与氨水发生反应:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() 。
。