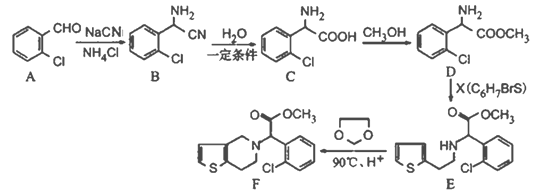
题目内容
【题目】(1)已知:①Fe(s)+1/2O2(g)=FeO(s) ΔH1=-272.0kJ·mol-1;
②2Al(s)+3/2O2(g)=Al2O3(s) ΔH2=-1675.7kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____(填“正”或“负”)极。F电极上的电极反应式为________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因______。


(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为____。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为___mol。
【答案】3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7kJ·mol-1 负 ClO-+2e-+H2O=Cl-+2OH- Mg+2H2O=Mg(OH)2+H2↑ HOOC—COOH+2e-+2H+=HOOC—CHO+H2O 2
【解析】
(1)由盖斯定律计算可得;
(2)由示意图可知,“镁﹣次氯酸盐”燃料电池中失电子的为负极,则镁合金为负极,电极反应式为Mg—2e—+2OH—=Mg(OH)2,铂合金为正极,正极上ClO﹣得电子生成氯离子,则正极的电极反应式为ClO﹣+2e﹣+H2O=Cl﹣+2OH﹣。
(3)根据H+的移动方向可知,M电极是阳极,Cl-在阳极上发生失电子的氧化反应生成Cl2,电极反应式为2Cl--2e-=Cl2↑,N电极为阴极,HOOC-COOH在阴极上得电子发生还原反应生成HOOC-CHO,电极反应式为HOOC-COOH+2e-+2H+=HOOC-CHO+H2O。
(1)依据盖斯定律计算②-①×3得到:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol;故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol;
(2)①由示意图可知,“镁﹣次氯酸盐”燃料电池中,E为镁合金,为燃料电池的负极,F为铂合金,为正极,正极上ClO﹣得电子生成氯离子,则正极的电极反应式为ClO﹣+2e﹣+H2O=Cl﹣+2OH﹣,故答案为:负;ClO-+2e-+H2O=Cl-+2OH-;
②Mg的活泼性较强能与水反应生成氢气,其反应为:Mg+2H2O=Mg(OH)2+H2↑,故答案为:Mg+2H2O=Mg(OH)2+H2↑;
(3)①N电极为电解池的阴极,HOOC-COOH在阴极上得电子发生还原反应生成HOOC-CHO,电极反应式为HOOC-COOH+2e-+2H+=HOOC-CHO+H2O,故答案为:HOOC-COOH+2e-+2H+=HOOC-CHO+H2O;
②2mol H+通过质子交换膜,则电池中转移2mol电子,根据电极方程式HOOC-COOH+2e-+2H+=HOOC-CHO+H2O,可知阴极生成1mol乙醛酸;阳极(M极)电极反应式为2Cl--2e-=Cl2↑,乙二醛与Cl2的反应为Cl2+OHC—CHO+H2O=HOOC—CHO+2HCl,根据题意和阴、阳极得失电子相等,阳极也生成1mol乙醛酸;由于两极均有乙醛酸生成,所以生成的乙醛酸为2mol,故答案为:2。

 教学练新同步练习系列答案
教学练新同步练习系列答案