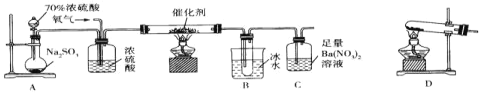
题目内容
【题目】可用以下方法处理尾气中的![]()
方法一:活性炭还原法:![]() ,一定条件下,各物质浓度与时间的关系如图:
,一定条件下,各物质浓度与时间的关系如图:
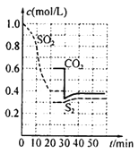
(1)该反应的平衡常数表达式为K=________,第一次达到平衡的时间是第_____min。
(2)0~20min化学反应速率表示υ(SO2)= _________。
(3)30min时平衡发生移动的条件是__________________。
方法二:亚硫酸钠吸收法
(1)![]() 溶液吸收
溶液吸收![]() 的离子方程式为_______________________。
的离子方程式为_______________________。
(2)常温下,当![]() 完全转化为
完全转化为![]() 时,溶液中相关离子浓度关系为:
时,溶液中相关离子浓度关系为:
![]() ______
______![]() (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
![]() ______
______![]() (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
【答案】K=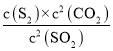 20 0.03mol/(Lmin) 减小CO2的浓度 SO32-+SO2+H2O→2HSO3- = >
20 0.03mol/(Lmin) 减小CO2的浓度 SO32-+SO2+H2O→2HSO3- = >
【解析】
方法一:(1)根据平衡常数的定义书写表达式;当反应达到平衡后反应体系中各物质的量不再随时间变化而变化;
(2)根据υ=![]() 计算υ(SO2);
计算υ(SO2);
(3)30min时瞬间,二氧化碳浓度降低,SO2、S2的浓度不变,而后二氧化碳、S2的浓度均增大;
方法二:(1)Na2SO3溶液与SO2反应生成亚硫酸氢钠;
(2)结合反应后溶液中的电荷守恒和物料守恒判断。
方法一:(1)反应![]() 的平衡常数表达式K=
的平衡常数表达式K=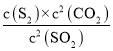 ;由图像可知当反应进行到20min时SO2、CO2和S2的物质的量浓度不再随时间的变化而变化,此时反应达到平衡状态;
;由图像可知当反应进行到20min时SO2、CO2和S2的物质的量浓度不再随时间的变化而变化,此时反应达到平衡状态;
(2)由图可知,0~20min内二氧化硫浓度变化量为1mol/L-0.4mol/L=0.6mol/L,故υ(SO2)=![]() =0.03mol/(Lmin);
=0.03mol/(Lmin);
(3)30min时瞬间,二氧化碳浓度降低,SO2、S2的浓度不变,而后二氧化碳、S2的浓度均增大,30min时瞬间应是减少CO2的浓度;
方法二:
(1)Na2SO3溶液与SO2反应生成亚硫酸氢钠,反应离子方程式为:SO32-+SO2+H2O→2HSO3-;
(2)反应后溶液中存在电荷守恒,即:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-);溶液中S元素以SO32-、HSO3-、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO4),则c(Na+)>c(SO32-)+c(HSO3-)。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
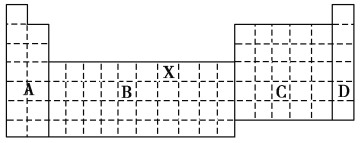
初中学业考试导与练系列答案【题目】右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.b为正极、a为负极 B.a为阳极、b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
【题目】25℃时,将两种不同浓度的某一元酸HA分别与NaOH溶液等体积混合(混合后溶液体积等于混合前两溶液体积之和),测得反应后溶液的pH如表所示。下列判断错误的是( )
实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
c(HA) | c(NaOH) | ||
① | 0.10 | 0.10 | 9 |
② | x | 0.05 | 7 |
A.HA是弱酸
B.![]()
C.实验①所得溶液中:![]() mol/L
mol/L
D.实验②所得溶液中:![]()