题目内容
17.A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都有10个电子,其结构特点如下表:| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)A粒子的结构示意图
 ,G的化学式是CH4.
,G的化学式是CH4.(2)比较BC和EC2的碱性强弱BC>EC2(填<、>、=).
(3)F与C反应生成D的离子方程式NH4++OH-=NH3.H2O.
分析 A、B、C、D、E、F、G都是由短周期元素构成的粒子,它们都有10个电子.A为单核,电荷为0,则A为Ne原子;B为单核,电荷为1+,则B为Na+;C为双核,电荷为1-,则C为OH-;D为多核,D是常温常压下能使湿润红色石蕊试纸变蓝色的气体,则D为NH3;E为单核,电荷为2+,则E为 Mg2+;F为多核,电荷为1+,C常用作F的检验(加热),则F为NH4+;G为多核,电荷为0,则G为CH4,据此解答.
解答 解:A、B、C、D、E、F、G都是由短周期元素构成的粒子,它们都有10个电子.A为单核,电荷为0,则A为Ne原子;B为单核,电荷为1+,则B为Na+;C为双核,电荷为1-,则C为OH-;D为多核,D是常温常压下能使湿润红色石蕊试纸变蓝色的气体,则D为NH3;E为单核,电荷为2+,则E为 Mg2+;F为多核,电荷为1+,C常用作F的检验(加热),则F为NH4+;G为多核,电荷为0,则G为CH4,
(1)A为Ne原子,核外电子数为10,有2个电子层,最外层电子数为8,结构示意图为其结构示意图为: ,G为CH4,
,G为CH4,
故答案为: ;CH4;
;CH4;
(2)BC为NaOH,EC2为Mg(OH)2,金属性Na>Mg,所以碱性NaOH>Mg(OH)2,
故答案为:>;
(3)F为NH4+,C为OH-,NH4+与OH-在溶液中反应生成NH3.H2O,离子方程式为:NH4++OH-=NH3.H2O,
故答案为:NH4++OH-=NH3.H2O.
点评 本题考查中学常见10电子微粒、常用化学用语、元素周期律等,难度不大,熟练掌握常见10电子、18电子微粒是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列离子方程式正确的是( )
| A. | 向NaHCO3溶液中加入过量的Ba(OH)2液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| B. | Na[Al(OH)4]溶液与NaHCO3溶液混合:[Al(OH)4]-+HCO3-═Al(OH)3↓+CO32-+H2O | |
| C. | 中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ | |
| D. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4++2H2O |
8.下列有关环境方面的说法不正确的是( )
| A. | 绿色化学的核心是应用化学原理治理产生的环境污染 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 采用天然石材装修家居,可减轻室内甲醛污染但会导致一定量的放射性物质的污染 | |
| D. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重 |
2.下列化学反应中,属于放热反应的是( )
| A. | Al+稀盐酸 | B. | Ba(OH)2•8H2O+NH4Cl(固体) | ||
| C. | KClO3受热分解 | D. | C和CO2反应 |
6.将几滴KSCN(SCN-是“类卤离子”)溶液加入酸性的含有Fe3+的溶液中,溶液变成红色,将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去.下列说法不正确的是( )
| A. | ①红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失 | |
| B. | ②红色褪去的原因是SO2将Fe3+还原为Fe2+ | |
| C. | ②红色褪去的原因是SO2将SCN-还原 | |
| D. | SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2 |
7.镤-239原子核内有148个中子.现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
| A. | 第3周期第ⅠA族 | B. | 第4周期第ⅠA族 | C. | 第5周期第ⅠA族 | D. | 第3周期第ⅡA族 |
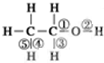 乙醇分子中化学键如图:
乙醇分子中化学键如图:
 .
.