题目内容
13.下列有关物质的用途叙述,错误的是( )| A. | 碳酸氢钠在医疗上可用于治疗胃酸过多 | |
| B. | 钠和钾的合金常温下是液态,可用于快中子反应堆作热交换剂 | |
| C. | 碳酸钠可用于玻璃,制皂,造纸、纺织等工业 | |
| D. | 氧化钠可用作漂白剂 |
分析 A.根据胃酸中的酸为盐酸及盐酸的化学性质进行分析,要治疗胃酸过多,可以选用能与盐酸反应的物质,且应选择无毒、无腐蚀性的物质;
B.钠钾合金常温下是液态,具有导热性;
C.根据碳酸钠的用途分析;
D.氧化钠没有漂白性.
解答 解:A.NaHCO3能与盐酸反应生成氯化钠、水和二氧化碳,能用来治疗胃酸过多症,故A正确;
B.钠钾合金常温下是液态,具有导热性,所以钠钾合金可用于原子反应堆作热交换剂,故B正确;
C.碳酸钠可用于制备硅酸钠、硬质酸钠等,所以可用于制玻璃、肥皂、造纸、纺织等工业,故C正确;
D.氧化钠没有漂白性,不能作漂白剂,过氧化钠具有强氧化性和漂白性,能作漂白剂,故D错误.
故选D.
点评 本题主要考查了物质的性质与用途,物质的性质决定了用途,难度不大.

练习册系列答案
相关题目
3.下列各离子方程式中,不属于水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+H+ | ||
| C. | PO43-+H2O═HPO42-+OH- | D. | NH3+H2O?NH4++OH- |
4.下列物质属于含有共价键的离子化合物的是( )
| A. | C2H2 | B. | KOH | C. | NaF | D. | C60 |
8.下列反应的离子方程式正确的是( )
| A. | 氯化铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 向苏打溶液中加入足量的醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
5.在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被50g质量分数为2.92%的盐酸中和.则该生成物的成分是( )
| A. | Na2O | B. | Na2O2 | C. | Na2O和Na2O2 | D. | 不能确定 |
5.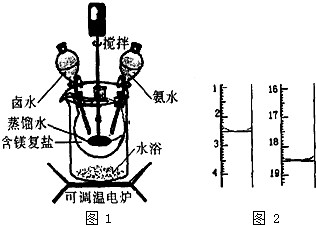 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
(1)本实验选择水浴加热方式,其优点是使反应物受热均匀,温度容易控制.
(2)40℃时复盐开始热解生成MgCO3•3H2O,并有气体产生,该反应的化学方程式为MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑.
(3)碱式碳酸镁产品中镁的质量分数[w(Mg)%]越高,产品质最越好,氯的质量分数越高,产品质量越差.某科研小组用沉淀滴定法分析产品中C1-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL的溶液.①在配制过程中必需要用到的一种计量仪器是电子天平或分析天平.准确最取25.00mL待测液,用硝酸银标准液进行滴定,滴定前后滴定管中的液面读数如图2所示,则滴定过程中消耗标准液的体积为16mL.
②已知某温度时,一些银盐的颜色和Ksp如下表:
则滴定时,可用作指示剂的是d.
a.CaCl2b.NaBr c.NaI d.K2CrO4
③滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀.
(4)已知制得的碱式碳酸镁可表示为xMgC03′yMg(OH)2H2O.若碱式碳酸镁的质量ag(不考虑微最杂质),充分灼烧后,测得剩余固体的质量为bg,产生的二氧他碳气体体积在标准状况下为cL,则碱式碳酸镁中x:y=40c:(22.4b-40c).(用b、c表示,不需化简)
 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.(1)本实验选择水浴加热方式,其优点是使反应物受热均匀,温度容易控制.
(2)40℃时复盐开始热解生成MgCO3•3H2O,并有气体产生,该反应的化学方程式为MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑.
(3)碱式碳酸镁产品中镁的质量分数[w(Mg)%]越高,产品质最越好,氯的质量分数越高,产品质量越差.某科研小组用沉淀滴定法分析产品中C1-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL的溶液.①在配制过程中必需要用到的一种计量仪器是电子天平或分析天平.准确最取25.00mL待测液,用硝酸银标准液进行滴定,滴定前后滴定管中的液面读数如图2所示,则滴定过程中消耗标准液的体积为16mL.
②已知某温度时,一些银盐的颜色和Ksp如下表:
| 难溶盐 | AgCl | AgBr | AgI | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 |
a.CaCl2b.NaBr c.NaI d.K2CrO4
③滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀.
(4)已知制得的碱式碳酸镁可表示为xMgC03′yMg(OH)2H2O.若碱式碳酸镁的质量ag(不考虑微最杂质),充分灼烧后,测得剩余固体的质量为bg,产生的二氧他碳气体体积在标准状况下为cL,则碱式碳酸镁中x:y=40c:(22.4b-40c).(用b、c表示,不需化简)
6.下列说法不正确的是( )
| A. | 按系统命名法,化合物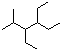 的名称为2-甲基-3,4-二乙基己烷 的名称为2-甲基-3,4-二乙基己烷 | |
| B. | 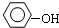 与 与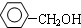 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |