题目内容
1.二氧化锰与过量浓盐酸反应可制取氯气:MnO2+4HC(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2 +2H2O+Cl2↑.现用浓盐酸与二氧化锰反应,制得的氯气在标况时的体积为11.2L,计算:(1)参加反应的二氧化锰的质量.(2)被氧化的HCl的物质的量.
分析 (1)根据n=$\frac{V}{Vm}$计算标准状况下11.2L的氯气的物质的量,根据方程式计算参加反应的二氧化锰的物质的量,再根据m=nM计算参加反应的二氧化锰的质量;
(2)根据反应原理,被氧化的HCl的物质的量是参加反应盐酸物质的量的一半,据此计算.
解答 解:(1)标准状况下11.2L的氯气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
令参加反应的二氧化锰的物质的量为n,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 1mol
n 0.5mol
所以:$\frac{1}{n}=\frac{1mol}{0.5mol}$,解得;n=0.5mol,
故参加反应的二氧化锰的质量为0.5mol×87g/mol=43.5g,
答:参加反应的二氧化锰的质量为43.5g;
(2)根据反应原理,设:参加反应的盐酸物质的量是y,则
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
4 1mol
y 0.5mol
$\frac{4}{y}=\frac{1mol}{0.5mol}$,解得y=2mol,被氧化的HCl的物质的量是参加反应盐酸物质的量的一半,被氧化的HCl的物质的量是1mol,
答:被氧化的HCl的物质的量是1mol.
点评 本题考查根据方程式的计算,比较基础,注意掌握根据方程式的计算格式,被氧化的HCl的物质的量是参加反应盐酸物质的量的一半是易错点.

 科学实验活动册系列答案
科学实验活动册系列答案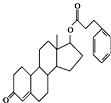
| A. | 含有两种官能团 | B. | 含有脂环 | ||
| C. | 是一种芳香化合物 | D. | 含有酯基 |
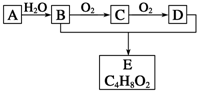 有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断正确的是( )
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断正确的是( )| A. | 鉴别A和甲烷可选择酸性高锰酸钾溶液 | |
| B. | B能与金属钠反应D不能 | |
| C. | 物质C和氢气反应生成乙醇,是还原反应 | |
| D. | E没有同分异构体 |
| A. | 28g | B. | 56g | C. | 14g | D. | 无法计算 |
| A. | 分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)--蒸馏 | |
| B. | 从含有少量NaCl的KNO3溶液中提取KNO3--热水溶解、降温结晶、过滤 | |
| C. | 从水中分离出碘的CCl4溶液--用分液漏斗分液 | |
| D. | 将溴水中的溴转移到有机溶剂中--加入酒精萃取 |
| A. | 碳酸氢钠在医疗上可用于治疗胃酸过多 | |
| B. | 钠和钾的合金常温下是液态,可用于快中子反应堆作热交换剂 | |
| C. | 碳酸钠可用于玻璃,制皂,造纸、纺织等工业 | |
| D. | 氧化钠可用作漂白剂 |
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 增大浓度或使用催化剂均能增大活化分子百分数,增大化学反应速率 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 铬的价电子电子排布式为3d54s1而不是3d44s2是因为半满稳定 |
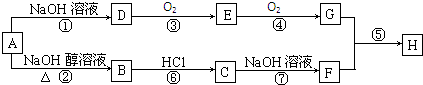
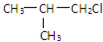 ,G的官能团名称是羧基
,G的官能团名称是羧基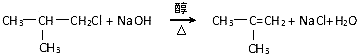 ;E与新制Cu(OH)2反应:
;E与新制Cu(OH)2反应: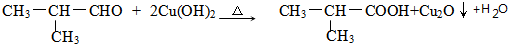 .
.