题目内容
19.新制氯水与久置氯水相比较,下列说法错误的是( )| A. | 颜色不同 | B. | 都能使滴有酚酞的NaOH溶液褪色 | ||
| C. | 都能使有色布条褪色 | D. | 加AgNO3溶液都能生成白色沉淀 |
分析 新制氯水含盐酸、次氯酸,含3种分子、4种离子;久置的氯水为盐酸溶液,含1种分子,3种离子,以此来解答.
解答 解:A.新制氯水为黄绿色,久置的氯水为无色,颜色不同,故A正确;
B.均能与NaOH溶液反应,使滴有酚酞的NaOH溶液褪色,故B正确;
C.新制氯水含次氯酸,能使有色布条褪色,而久置的氯水不能,故C错误;
D.均含氯离子,则加AgNO3溶液都能生成白色沉淀,故D正确;
故选C.
点评 本题考查氯水的成分及性质,为高频考点,注意把握新制、久置的氯水的成分不同是解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
9.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2molN2;的和0.6molH2的,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol/(L•min).
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0
,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2 的大小,K1>K2 (填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2
和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正>v(N2)逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
(1)若在一容积为2L的密闭容器中加入0.2molN2;的和0.6molH2的,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol/(L•min).
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0
,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2 的大小,K1>K2 (填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2
和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正>v(N2)逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
10.常温下,2L物质的量浓度为0.5mol•L-1Ba(OH)2溶液含有( )
| A. | 0.5mol的Ba2+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 2.0mol的OH- |
7.某元素的原子结构示意图为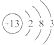 ,下列关于该元素的说法中,错误的是( )
,下列关于该元素的说法中,错误的是( )
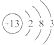 ,下列关于该元素的说法中,错误的是( )
,下列关于该元素的说法中,错误的是( )| A. | 它的阳离子带3个单位正电荷 | B. | 它是一种金属元素 | ||
| C. | 它的阳离子有10个质子 | D. | 其原子核外有13个电子 |
14.在120℃条件下,1mL气态混合物与10mLO2混合后点燃,最终测得气体的总体积为11mL.则该气态混合物可能是( )
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C3H8、CH3CH2OH | D. | C2H6、CH3CHO |
4.已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图.甲和X不可能是( )
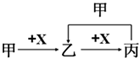
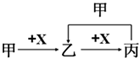
| A. | 甲为C,X为O2 | B. | 甲为Fe,X为Cl2 | ||
| C. | 甲为SO2,X为NaOH溶液 | D. | 甲为Fe,X为稀硝酸溶液 |
11.下列叙述正确的是( )
| A. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| B. | 将氢氧化钠溶液和氨水各稀释一倍,两者的c(OH-)均减少到原来的一半 | |
| C. | 常温下,某溶液中由水电离出的c(OH-)=1×10-10 mol/L,该溶液可能是盐酸 | |
| D. | 如果盐酸的物质的量浓度是醋酸的两倍,则盐酸的c(H+)也是醋酸的两倍 |
9.“酸化”是实验中经常采用的方法,下列说法正确的是( )
| A. | 提高高锰酸钾的氧化能力,用浓盐酸酸化 | |
| B. | 抑制Fe2+ 的水解,用稀硝酸酸化 | |
| C. | 检验某卤代烃中是否含氯元素,先加HNO3酸化,再加AgNO3溶液检验. | |
| D. | 确认溶液中含有SO42- 时,先用过量盐酸酸化,再加BaCl2溶液检验. |