题目内容
19.下列解释事实的方程式不正确的是( )| A. | 铝热法炼铁:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| B. | 工业进行“氮的固定”:N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | |
| C. | 铅蓄电池充电时阴极反应:PbSO4(s)+2e-=Pb(s)+SO42-(aq) | |
| D. | 用铜和稀硝酸制备硝酸铜:Cu+4H++2NO3-=Cu2++2NO2↑+2H2 |
分析 A.铝热法是铝单质和某些金属氧化法在高温条件下发生置换反应,生成活泼性弱于铝的金属单质;
B.工业固氮的第一步是以氮气和氢气为原料直接化合生成氨气,再通过氨气合成其他含氮化合物;
C.铅蓄电池充电时,阴极上是PbSO4得电子发生还原反应生成Pb单质;
D.铜与稀硝酸反应生成硝酸铜、一氧化氮气体和水,不是生成二氧化氮和氢气.
解答 解:A.铝热法炼铁为铝与氧化铁反应生成铁和氧化铝,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故A正确;
B.合成氨反应N2+3H2$?_{催化剂}^{高温、高压}$2NH3中单质中氮元素转化成化合物中的氮元素,该过程为“氮的固定”,故B正确;
C.铅蓄电池充电时阴极硫酸铅得到电子生成铅单质,阴极的电极反应式为:PbSO4(s)+2e-=Pb(s)+SO42-(aq),故C正确;
D.铜和稀硝酸反应生成硝酸铜、NO气体和水,反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO↑+2H2O,故D错误;
故选D.
点评 本题考查了化学方程式的书写判断,题目难度中等,涉及铝热反应、电解原理及其应用、工业固氮等知识,注意掌握化学方程式的书写原则,明确电解原理及其应用方法.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
9.乙醇、乙二醇、丙三醇分别与足量金属钠反应产生等体积的H2(相同状况下),则上述三种醇物质的量之比为( )
| A. | 2:3:6 | B. | 3:2:1 | C. | 4:3:1 | D. | 6:3:2 |
10.单斜硫和正交硫转化为二氧化硫的能量变化图如所示.下列说法正确的是( )
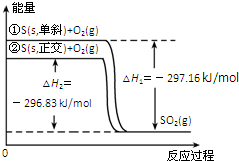

| A. | S(s,单斜)═S(s,正交)△H=+0.33kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 单斜硫燃烧的热化学方程式为:S(s,单斜)+O2(g)═SO2(g)△H=-296.83kJ•mol-1 | |
| D. | ①式表示断裂1 molO2中的共价键所吸收的能量比形成1 molSO2 中的共价键所放出的能量少297.16kJ |
14.下列判断正确的是( )
| A. | 通入足量CO2后的溶液中大量共存:Na+、SiO32-、CH3COO-、CO32- | |
| B. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| C. | NH4Al(SO4)2溶液中滴加足量的NaOH的离子方程式为:NH4++Al3++5OH-=NH3•H2O+AlO2-+2H2O | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 |
4.下列标志的高分子材料的单体,其中一种单体与其他三种单体均不是同系物的是( )
| A. |  HDPE高密度乙烯 | B. |  LDPE低密度乙烯 | C. |  DPP聚丙烯 | D. |  PS聚苯乙烯 |
11.室温时下列各组中的物质分别与足量NaOH溶液反应,生成盐种类最多的是( )
| A. | Cl2、SO2、H2SiO3、NH4Cl | B. | Al、CO、HCl、Al(NO3)3 | ||
| C. | N2、SiO2、CH3COOH、Na2CO3 | D. | Fe CaO、NH3H2O NaHCO3 |
8.化学与生产、生活密切相关.下列对物质的用途、解释中均正确的是( )
| 选项 | 物质 | 用途 | 解释 |
| A | 晶体硅 | 高纯硅广泛用于光导纤维、太阳能电池和计算机芯片 | 硅具有半导体性能 |
| B | 氧化铝 | 制作耐高温材料 | Al2O3熔点很高 |
| C | 硫酸钡 | 医学上用做钡餐 | Ba无毒 |
| D | 明矾 | 作消毒剂 | 明矾水解产生具有吸附性的胶体粒子 |
| A. | A | B. | B | C. | C | D. | D |
9.有专家指出,如果将燃烧产物如CO2、H2O、N2等利用太阳能使它们重新变成CH4、CH3OH、NH3等的构想能够成为现实,则下列说法中,错误的是( )
| A. | 可消除对大气的污染 | |
| B. | 可节约燃料 | |
| C. | 可缓解能源危机 | |
| D. | 此题中的CH4、CH3OH、NH3等为一级能源 |
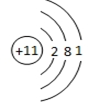 ,G在元素周期表中的位置为第三周期第ⅤⅡA族.
,G在元素周期表中的位置为第三周期第ⅤⅡA族.