题目内容
7.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.元素Z的离子与NH4+所含电子数和质子数均相同,ZX为离子化合物;Y、M同主族,化合物Cu2M和Cu2Y可发生如下转化(其中D是纤维素水解的最终产物):Cu2M$\stackrel{过量浓硝酸}{→}$澄清溶液$\stackrel{一定量NaOH}{→}$悬浊液$\stackrel{D的溶液}{→}$Cu2Y
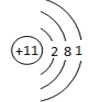
(1)Z的原子结构示意图为
 ,G在元素周期表中的位置为第三周期第ⅤⅡA族.
,G在元素周期表中的位置为第三周期第ⅤⅡA族.(2)X、Y、M间可以形成甲乙两种负一价的双原子阴离子,甲有18个电子,乙有10电子,则甲乙反应的离子方程式HS-+OH-=S2-+H2O
(3)ZX的电子式为Na+[:H]-.
(4)Cu2M与过量浓硝酸反应有红棕色气体生成,化学方程式为Cu2S+12HNO3(浓)=Cu(NO3)2+CuSO4+10NO2↑+6H2O.
(5)以Pt为电极电解X2Y2也可产生氧气,写出X2Y2水溶液电解过程中的电极反应式(已知:H2O2的氧化性及还原性均比H2O强):阴极H2O2+2H++2e-=2H2O;阳极H2O2-2e-=O2↑+2H+.
分析 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,ZX为离子化合物,则X一定为H元素;
元素Z的离子与NH4+所含电子数和质子数均相同,NH4+中含有10个电子,11个质子,则Z为Na元素;
D是纤维素水解的最终产物,则D为葡萄糖,则悬浊液与D的溶液(葡萄糖溶液)生成砖红色沉淀是氧化亚铜,则Y为O元素;又Y、M同主族,则M为S元素;G是短周期主族元素,其原子序数大于S元素,所以G是Cl元素(不考虑稀有气体),据此进行解答.
解答 解:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,ZX为离子化合物,则X一定为H元素;元素Z的离子与NH4+所含电子数和质子数均相同,NH4+中含有10个电子,11个质子,则Z为Na元素;D是纤维素水解的最终产物,则D为葡萄糖,则悬浊液与D的溶液(葡萄糖溶液)生成砖红色沉淀是氧化亚铜,则Y为O元素;又Y、M同主族,则M为S元素;G是短周期主族元素,其原子序数大于S元素,所以G是Cl元素(不考虑稀有气体),
(1)Z为Na元素,其原子序数为11,核外电子总数为10,钠原子结构示意图为: ;
;
G为Cl元素,位于周期表中第三周期第ⅤⅡA族,
故答案为: ;第三周期第ⅤⅡA族;
;第三周期第ⅤⅡA族;
(2)X、Y、M分别为H、O、S,三者间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,则甲中一定含有S原子,则甲为HS-,乙有10个电子,则乙为OH-,硫氢根离子与氢氧根离子发生中和反应生成硫离子和水,反应的离子方程式为:HS-+OH-=S2-+H2O,
故答案为:HS-+OH-=S2-+H2O;
(3)氢化钠是钠原子失去一个电子,氢原子得到这一个电子,均达到稳定结构的过程,原子之间通过得失电子形成的化学键为离子键,其电子式为:Na+[:H]-,
故答案为:Na+[:H]-;
(4)Cu2M为硫化亚铜,Cu2S与浓硝酸反应生成红棕色的气体NO2,Cu2S中铜从+1变为+1,化合价总共升高2价,S从-2变为+6,化合价升高了8价,总共升高10价,硝酸中+5价N被还原为+4,化合价降低1价,则化合价变化的最小公倍数为10,故硫化亚铜的系数为1,二氧化氮的系数为10,再结合质量守恒可知反应物中还生成硫酸铜,利用观察法配平可得该反应的方程式为:Cu2S+12HNO3(浓)=Cu(NO3)2+CuSO4+10NO2↑+6H2O,
故答案为:Cu2S+12HNO3(浓)=Cu(NO3)2+CuSO4+10NO2↑+6H2O;
(5)以Pt为电极电解H2O2也可产生氧气,电解总反应式为:2H2O2$\frac{\underline{\;电解\;}}{\;}$2H2O+O2↑,分析化合价变化可知阳极过氧化氢失电子生成氧气,电极反应式为:H2O2-2e-=O2↑+2H+,阴极过氧化氢得电子生成水,其电极反应式为:H2O2+2H++2e-=2H2O,
故答案为:H2O2+2H++2e-=2H2O; H2O2-2e-=O2↑+2H+.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,正确推断各元素名称为解答关键,注意 熟练掌握原子结构与元素周期表、元素周期律的关系,(4)为易错点,注意明确化合价升降相等在配平氧化还原反应中的应用.

| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ks或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 | |
| C. | 碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3 +Cl2+H2O=HCO-3+Cl-+HClO | |
| D. | 向浓度均为1×10-3mol•L-1的KCl和K2CrO4混合液中滴加1×10-3mol•L-1的AgNO3溶液,CrO2-4先形成沉淀. |
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
| A. | 只有① | B. | 只有①②⑤ | C. | 只有①②③⑤ | D. | ①②③④⑤ |

| A. | 放电时负极的电极反应式为Zn-2e-=Zn2+ | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 碳酸氢钠可作胃酸的中和剂 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
| A. | 铝热法炼铁:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| B. | 工业进行“氮的固定”:N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | |
| C. | 铅蓄电池充电时阴极反应:PbSO4(s)+2e-=Pb(s)+SO42-(aq) | |
| D. | 用铜和稀硝酸制备硝酸铜:Cu+4H++2NO3-=Cu2++2NO2↑+2H2 |
| A. | 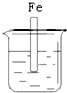 NaCl溶液 | B. | 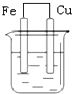 酸化的NaCl溶液 | C. | 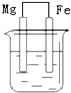 NaCl溶液 | D. |  NaCl溶液 |
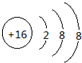 写出B的化学式Fe2O3
写出B的化学式Fe2O3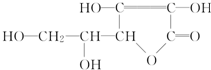 维生素C的结构简式如图所示:
维生素C的结构简式如图所示: