题目内容
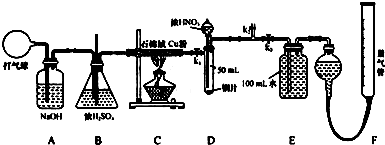
10.某实验装置如图所示,下列叙述正确的是( )
| A. | K与M、N均断开时,不发生任何化学反应 | |
| B. | K分别与M、N相连时,铜电极的质量都会增加 | |
| C. | K与N相连时,溶液中的Cl-向铜电极移动 | |
| D. | K与M相连时,Fe电极表面有铜析出 |
分析 A.K与M、N均断开时,该装置不能形成原电池或电解池,但Fe和氯化铜发生置换反应;
B.K与M相连时,该装置是电解池,Cu是阳极、Fe是阴极,阳极上Cu失电子生成铜离子进入溶液;K与N相连时该装置是原电池,Fe是负极、Cu是正极,正极上铜离子电子发生还原反应;
C.K与N相连时,该装置是原电池,Fe是负极、Cu是正极,电解质溶液中阴离子向负极移动、阳离子向正极移动;
D.K与M相连时,该装置是电解池,Cu是阳极、Fe是阴极,阴极上铜离子得电子发生还原反应.
解答 解:A.K与M、N均断开时,该装置不能形成原电池或电解池,但Fe和氯化铜发生置换反应,所以发生化学反应,故A错误;
B.K与M相连时,该装置是电解池,Cu是阳极、Fe是阴极,阳极上Cu失电子生成铜离子进入溶液,则Cu电极质量减小;K与N相连时该装置是原电池,Fe是负极、Cu是正极,正极上铜离子电子发生还原反应,则铜电极质量增加,故B错误;
C.K与N相连时,该装置是原电池,Fe是负极、Cu是正极,电解质溶液中阴离子向负极移动、阳离子向正极移动,所以溶液中的Cl-向Fe电极移动,故C错误;
D.K与M相连时,该装置是电解池,Cu是阳极、Fe是阴极,阴极上铜离子得电子发生还原反应,所以有Cu析出,故D正确;
故选D.
点评 本题考查原电池和电解池原理,为高频考点,明确原电池和电解池各个电极上发生的反应是解本题关键,易错点是判断离子移动方向,题目难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
20.下列实验操作的描述符合实验事实的是( )
| A. | 中和滴定实验中,滴定管和锥形瓶都要先洗涤、再润洗 | |
| B. | 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出 | |
| C. | 分馏时,温度计的水银球插入液面以下 | |
| D. | 除去KNO3中的NaCl杂质,可用溶解→加AgNO3溶液→过滤方法 |
1.一定温度下,将a mol PCl5气体通入容积不变的反应器中,达到平衡:PCl5(g)?PCl3(g)+Cl2(g),测得平衡混合气体压强为P1,此时再向反应器中通入a mol PCl5气体,在温度不变再达平衡,测得平衡混合气体压强为P2,则( )
| A. | 2P1=P2 | B. | 2P1>P2 | C. | 2P1<P2 | D. | 无法确定 |
15.在恒容密闭容器中投入1mol X(g)、2mol Y(g)进行如下反应:X(g)+2Y(g)?2W(g)△H,X的浓度与温度关系如图所示,下列判断不正确的是( )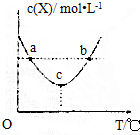
| A. | 上述反应中,△H<0 | |
| B. | c点时,消耗Y和W的速率相等 | |
| C. | 正反应速率:a<b | |
| D. | ac段,升高温度,平衡向正反应方向移动 |
2.用NA表示阿伏伽德罗常数的值,下列各物质所含的原子数是2NA的是( )
| A. | 16g H2 | B. | 16g S | C. | 24g Mg | D. | 24g C |
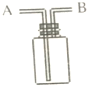 今有下列气体:H2、Cl2、O2、HCl、NH3、NO(难溶于水).用如图所示装置进行实验,请写下列空白:
今有下列气体:H2、Cl2、O2、HCl、NH3、NO(难溶于水).用如图所示装置进行实验,请写下列空白: