题目内容
20.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙(1)若甲为焦炭,丁为O2,写出丙转化成乙的化学方程式CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO检验乙中含有少量丙,可以选用试剂为澄清石灰水(填名称)
(2)若甲为NaOH,丁为CO2,则乙的化学式为Na2CO3除去乙溶液中含有少量丙的离子方程式为HCO3-+OH-=H2O+CO32-
(3)若甲为黄绿色气体,丁为日常生活中常见金属,则丙的化学式为FeCl2.
分析 (1)若甲为焦炭,丁为O2,碳与氧气反应生成乙为CO,CO与氧气反应生成丙为CO2,CO2与C反应生成CO,符合转化关系;
(2)若甲为NaOH,丁为CO2,NaOH与反应生成乙为碳酸钠,碳酸钠与CO2反应生成丙为碳酸氢钠,碳酸氢钠与NaOH反应生成碳酸钠,符合转化关系;
(3)若甲为黄绿色气体,则甲为氯气,丁为日常生活中常见金属,氯气能连续与丁反应,则丁为变价金属,所以丁为Fe,乙为氯化铁,在溶液中氯化铁与Fe反应生成丙为氯化亚铁,氯化亚铁被氯气氧化为氯化铁,符合转化关系;
解答 解:(1)若甲为焦炭,丁为O2,碳与氧气反应生成乙为CO,CO与氧气反应生成丙为CO2,CO2与C反应生成CO,丙转化成乙的化学方程式为CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,二氧化碳能使澄清石灰水变浑,而CO不能,所以检验CO中含有少量CO2,可以选用试剂为澄清石灰水,
故答案为:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;澄清石灰水;
(2)若甲为NaOH,丁为CO2,NaOH与反应生成乙为Na2CO3,Na2CO3与CO2反应生成丙为碳酸氢钠,碳酸氢钠与NaOH反应生成Na2CO3,所以除去乙溶液中含有少量丙,可以用氢氧化钠溶液,反应的离子方程式为HCO3-+OH-=H2O+CO32-,
故答案为:Na2CO3;HCO3-+OH-=H2O+CO32-;
(3)若甲为黄绿色气体,则甲为氯气,丁为日常生活中常见金属,氯气能连续与丁反应,则丁为变价金属,所以丁为Fe,乙为氯化铁,在溶液中氯化铁与Fe反应生成丙为FeCl2,FeCl2被氯气氧化为氯化铁,
故答案为:FeCl2.
点评 本题考查无机物推断,难度不大,需要学生熟练掌握元素化合物性质,有利于基础知识的巩固.

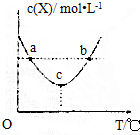
| A. | 上述反应中,△H<0 | |
| B. | c点时,消耗Y和W的速率相等 | |
| C. | 正反应速率:a<b | |
| D. | ac段,升高温度,平衡向正反应方向移动 |
| A. | 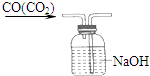 气体除杂 | B. | 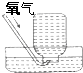 收集氧气 | C. | 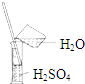 稀释溶液 | D. |  滴加溶液 |
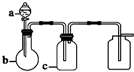 表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )
表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )| 选项 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 70%浓H2SO4 | Na2SO3固体 | 95%浓H2SO4 |
| C | NO | 稀硝酸 | 铜屑 | H2O |
| D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
①CSO的结构式:S═C═O
②Cl-的结构示意图:

③甲烷分子的比例模型:

④葡萄糖的分子式:C6H12O6
⑤原子核内有10个中子的氧原子${\;}_{8}^{10}$O
⑥HCO3-的水解方程式:HCO3-+H2O?CO3-+H3O+.
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤⑥ | D. | 全部正确 |
| A. | 不变 | B. | 不能确定 | C. | 减少 | D. | 增大 |
| A. | 探究温度对反应速率影响时,应先分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度后再混合,不是先将两种溶液混合后再用水浴加热 | |
| B. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| C. | 使用含有氯化钠的融雪剂会加快铁桥梁的腐蚀 | |
| D. | 判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
| A. | 与12C60的碳原子化学性质不同 | B. | 与15N含的中子数相同 | ||
| C. | 与12C60互为同素异形体 | D. | 与12C、13C互为同系物 |
