��Ŀ����
����Ŀ���軯����һ����Ҫ�Ļ�������ԭ�ϣ�ͬʱҲ��һ�־綾���ʡ�һ��й©��Ҫ��ʱ������һ�����ͨ������˫��ˮ���������(Na2S2O8)��Һ���������Լ��ỷ����Ⱦ��
I.��֪���Ȼ�����һ�ְ�ɫ�ᾧ��������ѧʽΪNaCN���о綾��������ˮ��ˮ��Һ�ʼ��ԣ���ˮ�������軯�⡣
(1)�����ʵ��֤��N��CԪ�صķǽ�����ǿ����______________________��
(2)NaCN��˫��ˮ��������һ����ʽ�κ�һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬�÷�Ӧ�����ӷ���ʽ��______________________��
��.��ҵ�Ʊ��������Ƶķ�Ӧԭ�����£�
����Ӧ��(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3��ʮ2H2O
Na2S2O8+2NH3��ʮ2H2O
����Ӧ��2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
ij��ѧ��ȤС����������ԭ����ʵ�����Ʊ��������Ʋ�����ù���������Һ��������軯�Ʒ�ˮ�Ƿ����ŷš�
��ʵ��һ��ʵ����ͨ����ͼ��ʾװ���Ʊ�Na2S2O8��
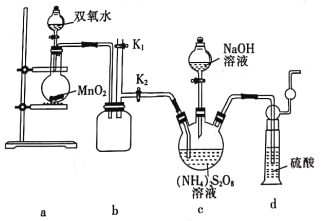
(3)װ��b��������______________________��
(4)װ��a�з�Ӧ������������Ҫ����ͨ��װ��c��ԭ����______________________��
(5)����װ���л��貹���ʵ��������װ����___________(����ĸ)��
A�¶ȼ� Bϴ��ƿ C.ˮԡװ�� D.�ƾ���
��ʵ������ⶨ�ù���������Һ������ķ�ˮ���軯�Ƶĺ�����
��֪���ٷ�ˮ���軯�Ƶ�����ŷű�Ϊ0.50mg��L��1��
��Ag++2CN��===[Ag(CN)2]����Ag++I��===AgI����AgI�ʻ�ɫ����CN��������Ag+��Ӧ��ʵ�����£�ȡ100.00mL��������軯�Ʒ�ˮ����ƿ�У����μӼ���KI��Һ��ָʾ����1.00��10��4mol��L��1�ı�AgNO3��Һ�ζ�������AgNO3��Һ�����Ϊ1.50mL��
(6)�ζ��յ��������____________________________________________��
(7)������ķ�ˮ���軯�Ƶ�Ũ��Ϊ___________mg��L��1��������ķ�ˮ�Ƿ�ﵽ�ŷű�?___________(��ǡ���)��
���𰸡�ȡ����̼���������Թ��У�����ϡ����,����ɫ���ݲ�����˵����������ǿ��̼�ᣬ�ǽ�����N>C CN-+ H2O2+ H2O= HCO3- +NH3�� ����ȫƿ����ֹ���� ��������ƿ�в�����NH3��ʱ�ų������ٸ���Ӧ�ķ��� ACD �������һ����������Һʱ����Һ�г��ֵ���ɫ�������Ұ�����ڳ�������ʧ 0.147 ��
��������
Na2S2O8���������Ʒ�Ӧ����(NH4)2S2O8��dװ�ô���β��NH3���������ʵ��Ʊ����ᴿʵ�������ע������������
(1)ȡ����̼���������Թ���,����ϡ����,����ɫ���ݲ�����˵����������ǿ��̼�ᣬ�ǽ�����Խǿ����Ԫ�ص�����������ˮ���������Խǿ����ǽ����ԣ�N>C��
�ʴ�Ϊ��N>C��
(2) NaCN��˫��ˮ��������һ����ʽ�κ�һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬����Ӧ������HCO3-��NH3�����ӷ���ʽΪ��CN-+ H2O2+ H2O= HCO3- +NH3����
�ʴ�Ϊ��CN-+ H2O2+ H2O= HCO3- +NH3����
(3) ���ڰ�����������ˮ������ϵ��ѹǿ���ټ�С����������������bװ���ǰ�ȫƿ����ֹ������
�ʴ�Ϊ������ȫƿ����ֹ������
(4) װ��a�з�Ӧ������O2����������ƿ�в�����NH3��ʱ�ų������ٸ���Ӧ�ķ�����
�ʴ�Ϊ����������ƿ�в�����NH3��ʱ�ų������ٸ���Ӧ�ķ�����
(5)������Ŀ��Ϣ��ʾ��֪���Ʊ���Ӧ��Ҫ��55��������½��У�������Ҫ�����¶Ȳ��ܳ���90�棬��Ҫˮԡ�������¶ȼƺ;ƾ�����
�ʴ�Ϊ��ACD��
(6)����������Һ�ζ��Ĺ����������������һ����������Һʱ����Һ�г��ֵ���ɫ�������Ұ�����ڳ�������ʧʱ��˵���Ѿ��ζ����յ���
�ʴ�Ϊ���������һ����������Һʱ����Һ�г��ֵ���ɫ�������Ұ�����ڳ�������ʧ��
(7)���ݻ�ѧ������ϵ��֪��Ag+����2CN-��n(AgNO3)= 1.00��10��4mol��L��1��0.0015mL=1.5��10-7mol����n(NaCN)=2 n(AgNO3) =1.5��10-7mol��2=3.0��10-7mol��m(NaCN)= 3.0��10-7mol��49g/mol=1.47��10-5g���軯�Ƶ�Ũ��Ϊ��![]() =0.147g/L��0.147g/L��0.50mg/L�������Ѵﵽ�ŷű���
=0.147g/L��0.147g/L��0.50mg/L�������Ѵﵽ�ŷű���
�ʴ�Ϊ��0.147���ǡ�