题目内容
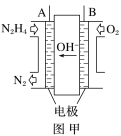
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )

A.电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B.a处通入氧气,b处通氢气
C.电池放电后,OH-的物质的量浓度减小
D.通入O2的电极发生反应:O2+4e-=2O2-
【答案】C
【解析】
根据二极管中(外电路)电子的流向可知a电极为负极,发生氧化反应,b电极为正极发生还原反应。
A.电子不能在电解质溶液中移动,故A错误;
B.根据分析可知a处为负极,氧气发生还原反应,应通入b处,故B错误;
C.放电总反应为2H2+O2=2H2O,产物为水,所以放电后OH-的物质的量浓度减小,故C正确;
D.电解质溶液中氧元素不能以O2-形式存在,碱性溶液中生成OH-,电极方程式为O2+2H2O+4e-=4OH-,故D错误;
故答案为C。

练习册系列答案
相关题目