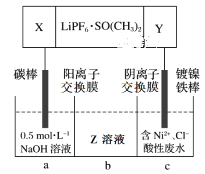
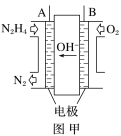
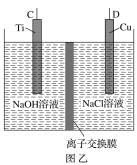
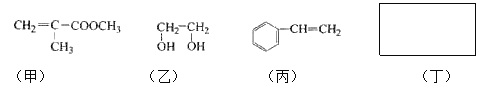
题目内容
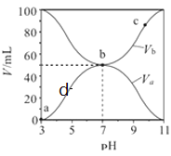
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的悬浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示,试回答:

(1)A点→B点反应的离子方程式为_______________________。
(2)原混合物中AlCl3的物质的量为______,NaOH的物质的量为_____。
(3)C点加入的HCl溶液体积为_____________。
【答案】AlO2-+H++H2O=Al(OH)3↓ 0.02 mol 0.13 mol 130 mL
【解析】
①盐酸加入量在0—10 mL时,沉淀的质量没有改变,说明把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后氢氧化钠有剩余,溶液中溶质为NaAlO2和NaOH,1.16 g白色沉淀是氢氧化镁,盐酸加入量在0—10 mL时,发生反应是H++OH-=H2O,②加入盐酸10—30 mL过程中,发生反应为:AlO2-+H++H2O=Al(OH)3↓,B点沉淀为Mg(OH)2、Al(OH)3,B→C发生反应为Mg(OH)2+ 2H+=Mg2++2 H2O、Al(OH)3+ 3H+=Al3++3H2O;
(1)A点→B点沉淀质量增大,该过程为NaAlO2与盐酸反应生成氢氧化铝沉淀和氯化钠,反应的离子方程式为AlO2-+H++H2O=Al(OH)3↓。
(2)A点→B点的反应离子方程式AlO2-+H++H2O=Al(OH)3↓,A点→B点消耗盐酸的体积为20mL,n(HCl)= 1 mol·L-1×0.02L=0.02mol,所以n(AlO2-)=0.02mol,根据铝元素守恒,原混合物中AlCl3的物质的量为0.02mol;根据纵坐标可以知道氢氧化镁的物质的量是![]() 0.02mol,根据镁元素守恒,原混合物中MgCl2的物质的量为0.02mol;原混合物溶于水时,发生了反应:Al3++4OH-=AlO2-+2H2O和Mg2++2OH-=Mg(OH)2↓,AlCl3和MgCl2消耗的NaOH的物质的量为0.02×4+0.02×2=0.12mol;根据图像,盐酸加入量在0—10 mL时,发生反应H++OH-=H2O,所以原混合物溶于水发生反应后剩余的NaOH为0.01mol,所以原有NaOH的物质的量为0.12mol+0.01mol=0.13mol。
0.02mol,根据镁元素守恒,原混合物中MgCl2的物质的量为0.02mol;原混合物溶于水时,发生了反应:Al3++4OH-=AlO2-+2H2O和Mg2++2OH-=Mg(OH)2↓,AlCl3和MgCl2消耗的NaOH的物质的量为0.02×4+0.02×2=0.12mol;根据图像,盐酸加入量在0—10 mL时,发生反应H++OH-=H2O,所以原混合物溶于水发生反应后剩余的NaOH为0.01mol,所以原有NaOH的物质的量为0.12mol+0.01mol=0.13mol。
(3)B点沉淀为Mg(OH)2、Al(OH)3,根据(2)可知氢氧化铝和氢氧化镁的物质的量均为0.02mol,B→C发生反应为Mg(OH)2 + 2H+ = Mg2+ +2 H2O、Al(OH)3 + 3H+ = Al3+ + 3H2O;所以B→C消耗盐酸的物质的量是0.02mol×2+0.02mol×3=0.1mol,盐酸的体积是![]() 0.1L=100mL,C点加入的HCl溶液体积为100mL+30mL=130mL。
0.1L=100mL,C点加入的HCl溶液体积为100mL+30mL=130mL。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案