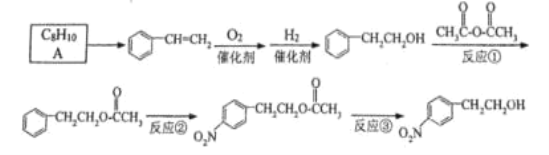
题目内容
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=206.2kJmol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=247.4 kJmol-1
2H2S(g)===2H2(g)+S2(g) ΔH=169.8 kJmol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为__________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是_____。燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,则该反应的化学方程式是______。
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图1所示。
①在图示的转化中,化合价不变的元素是______。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为______。
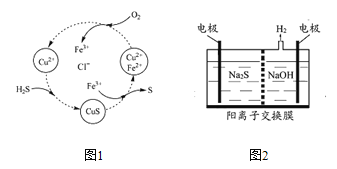
(4)将烧碱吸收H2S后的溶液加入到图2所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2--2e-=== S (n-1)S + S2-=== Sn2-
①写出电解时阴极的电极反应式________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成______。
【答案】CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H=+165.0 kJmol-1 为H2S热分解反应提供热量 2H2S+SO2 ===2H2O+3S 或 4H2S+2SO2===4H2O+3S2 Cu、H、Cl(或铜、氢、氯) 0. 5 mol 2H2O +2e-=== H2↑+ 2OH- Sn2- +2H+=== (n-1)S↓+ H2S↑
【解析】
(1). CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H=+165.0 kJmol-1 (2). 为H2S热分解反应提供热量 (3). 2H2S+SO2 ===2H2O+3S 或 4H2S+2SO2===4H2O+3S2 (4). Cu、H、Cl(或铜、氢、氯) (5). 0. 5 mol (6). 2H2O +2e-=== H2↑+ 2OH- (7). Sn2- +2H+=== (n-1)S↓+ H2S↑

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知下列四组实验,现象和结论均正确的是( )
操作 | 现象 | 结论 | |
A | 滴加稀NaOH溶液,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
B | 将SO2通入Ba(NO3)2溶液中 | 出现白色沉淀 | 沉淀为BaSO3 |
C | 在Na2S溶液中滴加新制氯水 | 产生浅黄色沉淀 | 非金属性:C1>S |
D | 将稀硝酸加入过量铁粉中,充分反应后,滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化成Fe3+ |
A.AB.BC.CD.D