题目内容
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为______,G的原子结构示意图是____。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为____,所含化学键类型为____。向甲中滴加足量水时发生反应的化学方程式是______。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是_____。(用离子符号表示)
【答案】第二周期第ⅤA族 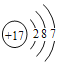
![]() 离子键和非极性共价键(或离子键和共价键) 2Na2O2+2H2O=4NaOH+O2↑ S2->Cl->Na+
离子键和非极性共价键(或离子键和共价键) 2Na2O2+2H2O=4NaOH+O2↑ S2->Cl->Na+
【解析】
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,B为碳元素;D元素是地壳中含量最多的元素,则D为氧元素;C原子序数介于碳、氧之间,C为氮元素;E元素是短周期元素中金属性最强的元素,则E为Na元素;F与G的位置相邻,G是同周期元素中原子半径最小的元素,可推知F为S元素、G为Cl元素,据此分析解答。
根据上述分析,A为氢元素,B为碳元素,C为氮元素,D为氧元素,E为Na元素,F为S元素,G为Cl元素。
(1)C是氮元素,原子核外有2个电子层,最外层电子数为5,在元素周期表中位于第二周期第VA族,G为Cl元素,原子结构示意图是 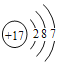 ,故答案为:第二周期第VA族;
,故答案为:第二周期第VA族;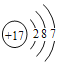 ;
;
(2)D与E按原子个数比1∶1形成的化合物甲为Na2O2,其电子式为![]() ,所含化学键有离子键、共价键;向过氧化钠中滴加足量水发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:
,所含化学键有离子键、共价键;向过氧化钠中滴加足量水发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:![]() ;离子键、共价键;2Na2O2+2H2O=4NaOH+O2↑;
;离子键、共价键;2Na2O2+2H2O=4NaOH+O2↑;
(3)电子层结构相同的离子,核电荷数越大,离子半径越小,离子的电子层越多,离子半径越大,故离子半径由大到小的顺序是:S2->Cl->Na+,故答案为:S2->Cl->Na+。

【题目】一定温度下,向容积为2 L的密闭容器中充入一定量的气体A和气体B,发生反应: 2A(g)+B(g) ![]() 2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
反应时间/min | n(A)/mol | n(B)/mol |
0 | 0.10 | 0.060 |
t1 | 0.012 | |
t2 | 0.016 |
A. 在0~t1 min内的平均反应速率为v(C)=0.088/t1 molL-1min-1
B. 其他条件不变,起始时向容器中充入0.10 mol C和0.010 mol B,平衡时n(A)=0.012 mol
C. 保持其他条件不变,升高温度,平衡时c(A)=0.0070 molL-1,则反应的ΔH>0
D. 相同温度下,起始时向容器中充入0.15mol A和0.090mol B,平衡时A转化率大于88%