题目内容
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
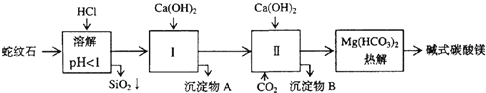
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是_____。
(2)从沉淀混合物A含有Fe(OH)3和Al(OH)3)中提取红色氧化物作颜料,先向沉淀物A中加入____溶液 (填入物质的化学式),然后_____、_____、____ (依次填写实验操作名称)。
(3) 物质循环使用,能节约资源。上述实验中,可以循环使用的物质是____(填写物质化学式)。
(4)18.2g产品碱式碳酸镁:aMgCO3·bMg(OH)2·cH2O完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中: a=_____、b=_____、c=___。(列式计算)。
【答案】Fe3+ 、Al3+ NaOH 过滤 洗涤 灼烧 CO2 3 1 3
【解析】
蛇纹石矿的主要成分为MgO、Fe2O3、Al2O3、SiO2,加入盐酸溶解,SiO2不溶于盐酸,MgO、Fe2O3、Al2O3与盐酸反应生成氯化镁、氯化铁和氯化铝;再加入氢氧化钙生成氢氧化铁和氢氧化铝,再加入二氧化碳生成碳酸氢镁,最后热解生成碱式碳酸镁。
(1)综上分析,加入盐酸溶解后,溶液中含有金属离子Mg2+ 、Fe3+ 、Al3+。
(2) 从沉淀混合物A含有Fe(OH)3和Al(OH)3)中提取红色氧化物作颜料Fe2O3,先要除去氢氧化铝,故先加入氢氧化钠生成可溶性Na[Al(OH)4],然后过滤,对沉淀Fe(OH)3进行洗涤、灼烧生成Fe2O3。
(3) 从实验步骤图知:步骤Ⅱ中通二氧化碳,作为第Ⅱ步的原料,碱式碳酸氢镁分解得到CO2,可以循环使用的物质是CO2。
(4) m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分解:aMgCO3bMg(OH)2cH2O![]() (a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3。
(a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案