题目内容
【题目】我国是世界上较早冶炼锌的国家。在现代工业中,锌更是在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点为419.6℃,沸点907℃。
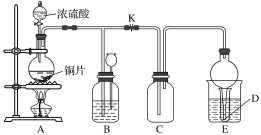
I.图是古代以炉甘石(ZnCO3)为原料炼锌的示意图。
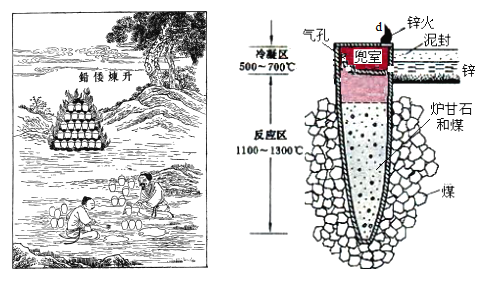
(1)泥罐内的主要反应为:
i.ZnCO3(s) = ZnO(s) + CO2(g) H1
ii.CO2(g) + C(s) = 2CO(g) H 2
……
总反应:ZnCO3(s) + 2C(s) = Zn(g) + 3CO(g) H3
利用H1和H 2计算时H3,还需要利用_________反应的H。
(2)泥罐中,金属锌的状态变化是_____;d口出去的物质主要是_______。
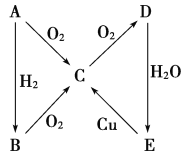
Ⅱ.现代冶炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2,还含铁等元素)为原料联合生产锌和高纯度二氧化锰的一种工艺的主要流程如下:
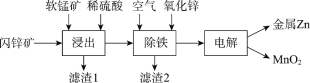
(3)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
ⅰ:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O
ⅱ:……
① 写出ⅱ的离子方程式:_________。
② 下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.________。
(4)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是_________。
(5)电解:用惰性电极电解时,阳极的电极反应是______。
(6)电解后的溶液中可循环利用的物质是___________。
【答案】ZnO(s) + C(s) = Zn(g) + CO(g) 气态变为液态 CO和Zn蒸气 ZnS+2Fe3+ = Zn2++2Fe2++S 取a中红色溶液,向其中加入ZnS,振荡,红色褪去 通入空气时,发生反应4Fe2++O2+8H2O= 4FeOOH+8H+使溶液的pH下降,加入的ZnO与H+发生反应ZnO+ 2H+ =H2O+Zn2+,可控制溶液pH Mn2+ - 2e-+2H2O = MnO2+4H+ 硫酸
【解析】
I.古代以炉甘石(ZnCO3)为原料炼锌的各步反应:i.ZnCO3(s) = ZnO(s) + CO2(g)、CO2(g) + C(s) = 2CO(g) 、ZnO(s) + C(s) = Zn(g) + CO(g),总反应:ZnCO3(s) + 2C(s) = Zn(g) + 3CO(g),反应区温度达到1100~1300℃,Zn变为蒸气与杂质分离,在“兜室”冷凝为液体流出(冷凝区温度高于Zn的熔点),为防止Zn被氧化而用“泥封”隔绝空气,出口“锌火”是未反应完的CO和Zn蒸气从“兜室”逸出燃烧。
Ⅱ.现代冶炼锌流程图中的各步反应:
浸出:ⅰ:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O,ii.ZnS+2Fe3+ = Zn2++2Fe2++S,总把反应:MnO2+ZnS+4H+ ![]() Mn2++S+Zn2++2H2O;
Mn2++S+Zn2++2H2O;
除铁:4Fe2++O2+8H2O=4FeOOH+8H+使溶液的pH下降,加入的ZnO与H+发生反应ZnO+ 2H+=H2O+Zn2+,可控制溶液pH;
电解:用惰性电极电解时,阳极的电极反应是Mn2+ - 2e-+2H2O = MnO2+4H+,生成的硫酸和MnO2循环使用。阴极:Zn2++2e-=Zn。
I.(1)泥罐内的主要反应为:
i.ZnCO3(s) = ZnO(s) + CO2(g) H1
ii.CO2(g) + C(s) = 2CO(g) H 2
……
总反应:ZnCO3(s) + 2C(s) = Zn(g) + 3CO(g) H3
根据盖斯定律:总反应-i-ii得ZnO(s) + C(s) = Zn(g) + CO(g),H=H3-H1-H 2,利用H1和H 2计算时H3,还需要利用ZnO(s) + C(s) = Zn(g) + CO(g)反应的H。故答案为:ZnO(s) + C(s) = Zn(g) + CO(g);
(2)锌的熔点为419.6℃,沸点907℃,泥罐中,温度由1100~1300℃变成500~700℃,金属锌的状态变化是气态变为液态;出口处主要是末反应CO和Zn蒸气在出口处燃烧,形成“锌火”,d口出去的物质主要是CO和Zn蒸气。故答案为:气态变为液态;CO和Zn蒸气;
Ⅱ.(3)① Fe2+的作用类似催化剂,ⅱ中应将Fe3+还原成Fe2+,ZnS的溶解的离子方程式:ZnS+2Fe3+ = Zn2++2Fe2++S。故答案为:ZnS+2Fe3+ = Zn2++2Fe2++S;
② 证实上述“催化”过程的实验方案:
a.检验Fe2+被氧化成Fe3+:向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.检验Fe3+被还原成Fe2+:取a中红色溶液,向其中加入ZnS,振荡,红色褪去。故答案为:取a中红色溶液,向其中加入ZnS,振荡,红色褪去;
(4)除铁:通入空气需同时补充适量ZnO的理由是:通入空气时,发生反应4Fe2++O2+8H2O=4FeOOH+8H+使溶液的pH下降,加入的ZnO与H+发生反应ZnO+ 2H+=H2O+Zn2+,可控制溶液pH。故答案为:通入空气时,发生反应4Fe2++O2+8H2O= 4FeOOH+8H+使溶液的pH下降,加入的ZnO与H+发生反应ZnO+ 2H+ =H2O+Zn2+,可控制溶液pH;
(5)电解:用惰性电极电解时,阳极发生氧化反应,将Mn2+氧化成MnO2,阳极的电极反应是Mn2+ - 2e-+2H2O = MnO2+4H+。故答案为:Mn2+ - 2e-+2H2O = MnO2+4H+;
(6)电解后的溶液中生成硫酸,可循环利用。故答案为:硫酸。

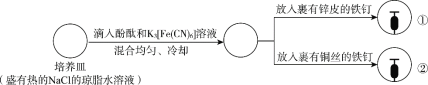
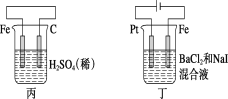
【题目】下列根据实验操作及现象进行的分析和推断中,不正确的是
操作 |
|
现象 | 一段时间后:①中,铁钉裸露在外的附近区域变红; ②中…… |
A.NaCl的琼脂水溶液为离子迁移的通路
B.①中变红是因为发生反应2H++2e-=H2↑,促进了水的电离
C.②中可观察到铁钉裸露在外的附近区域变蓝,铜丝附近区域变红
D.①和②中发生的氧化反应均可表示为M—2e-=M2+(M代表锌或铁)