题目内容
【题目】工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g) + O2(g) ![]() 2SO3(g) + Q
2SO3(g) + Q ![]()
(1)若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
|
| 平衡常数K |
________ | ________ | ________ |
(2)2SO2(g) + O2(g) ![]() 2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
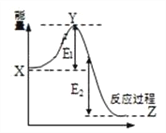
A.加入催化剂,X点位置升高
B.反应热 = E1 + E2
C.反应物总能量低于生成物
D.加入催化剂,E2不变
(3)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
实验1从开始到反应达到化学平衡时,用去时间2分钟,则υ(SO2)表示的反应速率为_________;T1________T2(填“>”、“<”或“=”)。制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
(4)0.1mol/L的NaHSO3溶液中c(H+) > c(OH-),用水解和电离理论的角度解释其原因___________________;若往溶液中加入氨水至中性,则c(Na+)______c(HSO3-) + c(SO32-) + c(H2SO3)(填“>”、“﹤”或“=”)。
(5)往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-)的比值____________(填“变大”、“变小”或“保持不变”)。
【答案】 增大 增大 减小 D 0.6mol/(L· min) > HSO3-的电离程度大于水解程度 = 变小
【解析】试题分析: (1) 2SO2(g) + O2(g) ![]() 2SO3(g) ,升高温度反应速率增大,正反应放热,升高温度平衡逆向移动。(2)
2SO3(g) ,升高温度反应速率增大,正反应放热,升高温度平衡逆向移动。(2)
加入催化剂,降低活化能,催化剂不能改变反应焓变;(3)反应速率为根据![]() 计算;(4)HSO3-水解呈碱性,HSO3-电离呈酸性;NaHSO3中满足钠元素的物质的量与硫元素的物质的量相等;(5)SO32-浓度越大,水解程度越小。
计算;(4)HSO3-水解呈碱性,HSO3-电离呈酸性;NaHSO3中满足钠元素的物质的量与硫元素的物质的量相等;(5)SO32-浓度越大,水解程度越小。
解析: (1) 温度从300℃升至400℃,正逆反应速率均增大,升高温度平衡逆向移动,所以平衡常数减小;(2)加入催化剂,降低活化能,Y点位置降低,X点位置不变,故A错误;
反应热生成物的总能量减反应物的总能量= -E2,故B错误;
C.反应放热,反应物总能量大于生成物,故C错误;
D.催化剂不能改变反应焓变,加入催化剂,E2不变,故D正确;
(3)

υ(SO2)表示的反应速率为![]() =
=![]() 0.6mol/(L· min);
0.6mol/(L· min);
2SO2(g) + O2(g) ![]() 2SO3(g) 正反应放热,所以升高温度平衡逆向移动,
2SO3(g) 正反应放热,所以升高温度平衡逆向移动, ![]() 平衡时SO2的浓度0.8 mol/L大于
平衡时SO2的浓度0.8 mol/L大于![]() 平衡时SO2的浓度,所以
平衡时SO2的浓度,所以![]() >
>![]() ;(4)HSO3-水解呈碱性,HSO3-电离呈酸性;电离大于水解所以溶液呈酸性;往NaHSO3溶液中加入氨水至中性,根据物料守恒,c(Na+)=c(HSO3-) + c(SO32-) + c(H2SO3);(5)SO32-浓度越大,水解程度越小;往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-) 的比值变小;
;(4)HSO3-水解呈碱性,HSO3-电离呈酸性;电离大于水解所以溶液呈酸性;往NaHSO3溶液中加入氨水至中性,根据物料守恒,c(Na+)=c(HSO3-) + c(SO32-) + c(H2SO3);(5)SO32-浓度越大,水解程度越小;往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-) 的比值变小;

 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】下表为元素周期表的一部分:
IA | IIA | ⅢA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是_______________(填写元素符号);①的核外电子排布式_______;③和⑥两元素形成化合物的电子式为________。
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是__________(填化学式)。
(3)比较④、⑤两种元素的简单离子半径:___>____(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为__________________。
(4)列举一个事实来证明元素①比元素⑤的非金属性强__________________。
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式___________________。