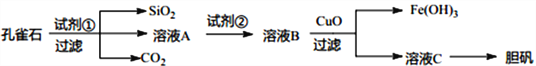
��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ���֣�
IA | IIA | ��A | IVA | VA | VIA | VIIA | ||
�� | C | N | �� | |||||
�� | �� | �� | �� | P | �� | �� |
����д���пհף�
��1������Ԫ�أ�ԭ�Ӱ뾶������_______________����дԪ�ط��ţ����ٵĺ�������Ų�ʽ_______���ۺ͢���Ԫ���γɻ�����ĵ���ʽΪ________��
��2���ڢۢ�����Ԫ������������Ӧ��ˮ�����У�������ǿ����__________���ѧʽ����
��3���ȽϢܡ�������Ԫ�صļ����Ӱ뾶��___��____�������ӷ��ţ���Ԫ�آ�����������Ӧ��ˮ���������ᷴӦ�����ӷ���ʽΪ__________________��
��4���о�һ����ʵ��֤��Ԫ�آٱ�Ԫ�آݵķǽ�����ǿ__________________��
��5����8g����������ȫȼ������Һ̬ˮʱ�ų�445.15kJ����������д�����Ȼ�ѧ����ʽ___________________��
���𰸡� Na 1s22s22p4 ![]() NaOH S2- Al3+ Al(OH)3+3H+��Al3++3H2O H2O���ȶ��Դ���H2S���������ɣ� CH4(g)+2O2(g)��CO2(g)+2H2O(l) +890.3kJ
NaOH S2- Al3+ Al(OH)3+3H+��Al3++3H2O H2O���ȶ��Դ���H2S���������ɣ� CH4(g)+2O2(g)��CO2(g)+2H2O(l) +890.3kJ
�����������Ԫ�����ڿ�֪����ΪOԪ�ء���ΪNaԪ�ء���ΪMgԪ�ء���ΪAlԪ�ء���ΪSԪ�ء���ΪClԪ�أ�
(1)ͬ���ں˵����Խ��ԭ�Ӱ뾶ԽС�������Ԫ�أ�ԭ�Ӱ뾶������Na��O�ĺ˵����Ϊ8����̬��ԭ�ӵĺ�������Ų�ʽΪ1s22s22p4��Mg��Cl��Ԫ���γ�MgCl2Ϊ���ӻ���������ʽΪ![]() ��
��
(2)Na��Mg��Al����Ԫ���н�������ǿ����Na��������������Ӧ��ˮ�����У�������ǿ����NaOH��
(3)Al3+�������������Ӳ㣬��S2-�������������Ӳ㣬�����Ӱ뾶 S2- ��Al3+��Al����������Ӧ��ˮ����Al(OH)3�����ᷴӦ�����ӷ���ʽΪAl(OH)3+3H+��Al3++3H2O��
(4)Ԫ�صķǽ�����Խǿ���⻯��Խ�ȶ�����H2O���ȶ��Դ���H2S����֪O�ķǽ����Ա�Sǿ��
(5)8g��������ʵ���Ϊ0.5mol������ȫȼ������Һ̬ˮʱ�ų�445.15kJ����������1mol������ȫȼ������Һ̬ˮʱ�ų�������Ϊ445.15kJ��2=890.3kJ����Ӧ���Ȼ�ѧ����ʽΪCH4(g)+2O2(g)��CO2(g)+2H2O(l) +890.3kJ��

 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�����Ŀ����ҵ������Ĺ����У�SO2��������ԭ��Ϊ��2SO2(g) + O2(g) ![]() 2SO3(g) + Q
2SO3(g) + Q ![]()
��1�����¶ȴ�300������400�棬���´ﵽƽ�⣬�ж����б����и��������ı仯����ѡ���������С�����䡱��
|
| ƽ�ⳣ��K |
________ | ________ | ________ |
��2��2SO2(g) + O2(g) ![]() 2SO3(g)���̵������仯��ͼ��ʾ������˵����ȷ����_________
2SO3(g)���̵������仯��ͼ��ʾ������˵����ȷ����_________
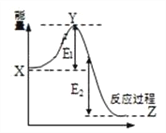
A�����������X�������
B����Ӧ�� = E1 + E2
C����Ӧ������������������
D�����������E2����
��3����һ������SO2(g)��O2(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ�õ����±��е��������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱ����ȥʱ��2���ӣ����(SO2)��ʾ�ķ�Ӧ����Ϊ_________��T1________T2�������������������������ȡSO2��β����NaOH��Һ���գ��ɵõ�Na2SO3��NaHSO3�����Ρ�
��4��0.1mol/L��NaHSO3��Һ��c(H+) > c(OH��)����ˮ��͵������۵ĽǶȽ�����ԭ��___________________��������Һ�м��백ˮ�����ԣ���c(Na+)______c(HSO3��) + c(SO32��) + c(H2SO3)���>������������=������
��5����0.1 mol/L��Na2SO3��Һ��������Na2SO3���壬��ȫ�ܽ����Һ��c(Na+) : c(SO32��)�ı�ֵ____________����������С�����ֲ��䡱����
����Ŀ���屽��һ�ֳ��õĻ���ԭ�ϡ�ʵ�����Ʊ��屽��ʵ�鲽�����£�

����1����a�м���15 mL����������м���ٽ�b��4.0 mLҺ���������뵽a�У���ַ�Ӧ������___________(������)������ ��b�е�Һ���������뵽a�У������ܿ��ټ����ԭ����___________�������μ�Һ����ꡣװ��d��������___________________��
����2����a�м���10 mLˮ��Ȼ��________(���������)��ȥδ��Ӧ����м��
����3����Һ������10 mLˮ��8 mL 10%��NaOH��Һ��10 mLˮϴ�ӣ���Һ�ô��屽��NaOH��Һϴ�ӵ�������____________��
����4����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����˼��ôֲ�Ʒ�������Ȼ��Ƶ�Ŀ����______________��
��֪�����屽���й������������ϱ���
�� | �� | �屽 | |
�ܶ�/g��cm��3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
��ˮ�е��ܽ�� | �� | �� | �� |
��1��ʵ��װ���У�����c������Ϊ_____��������������������������Ҫ������___________________���ѧʽ��
��2������4�õ��Ĵֲ�Ʒ�л��������ʱ�������Ҫ��һ���ᴿ�ֲ�Ʒ����������е�ʵ�����������__________________��