题目内容
【题目】酯类是工业上重要的有机原料,具有广泛用途。下图是乙酸乙酯的合成路线图,已知A能与银氨溶液反应析出银镜,B的水溶液可以溶解CaCO3,E可作果实催熟剂。

请完成下列问题:
(1)A的名称是_________;B中所含的官能团是____________;反应③的类型是_____________;反应④的类型是_____________。
(2)A的结构简式为___________________;E的结构简式为_________________________。
(3)请写出反应①、③、④的化学方程式:
①__________________________________________________________。
③__________________________________________________________。
④__________________________________________________________。
【答案】 乙醛 羧基(或—COOH) 酯化(或取代反应) 加成反应 CH3CHO CH2=CH2 2CH3CH2OH + O2![]() 2CH3CHO+2H2O CH3CH2OH + CH3COOH
2CH3CHO+2H2O CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 +H2O CH2=CH2 + HCl
CH3COOCH2CH3 +H2O CH2=CH2 + HCl![]() CH3CH2Cl
CH3CH2Cl
【解析】试题分析:乙醇能被氧气氧化为乙醛,A能与银氨溶液反应析出银镜,所以A是乙醛;乙醛能氧化为乙酸, B的水溶液可以溶解CaCO3,所以B是乙酸,E可作果实催熟剂,E是乙烯;氯乙烷在氢氧化钠水溶液中加热生成乙醇,C是乙醇,乙酸、乙醇发生酯化反应生成乙酸乙酯。
解析:根据以上分析,(1)A的名称是乙醛;B是乙酸,含的官能团是羧基;乙酸、乙醇发生反应生成乙酸乙酯和水,类型是酯化(或取代反应);乙烯与氯化氢反应生成氯乙烷,反应类型是加成反应。
(2)乙醛的结构简式为CH3CHO;乙烯的结构简式为CH2=CH2。
(3)请写出反应①、③、④的化学方程式:
①乙醇氧化为乙醛的方程式为2CH3CH2OH + O2![]() 2CH3CHO+2H2O 。
2CH3CHO+2H2O 。
③乙酸、乙醇发生反应生成乙酸乙酯和水的方程式为CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 +H2O 。
CH3COOCH2CH3 +H2O 。
④乙烯与氯化氢反应生成氯乙烷的方程式为CH2=CH2 + HCl![]() CH3CH2Cl。
CH3CH2Cl。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g) + O2(g) ![]() 2SO3(g) + Q
2SO3(g) + Q ![]()
(1)若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
|
| 平衡常数K |
________ | ________ | ________ |
(2)2SO2(g) + O2(g) ![]() 2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
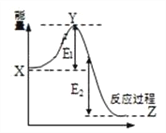
A.加入催化剂,X点位置升高
B.反应热 = E1 + E2
C.反应物总能量低于生成物
D.加入催化剂,E2不变
(3)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
实验1从开始到反应达到化学平衡时,用去时间2分钟,则υ(SO2)表示的反应速率为_________;T1________T2(填“>”、“<”或“=”)。制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
(4)0.1mol/L的NaHSO3溶液中c(H+) > c(OH-),用水解和电离理论的角度解释其原因___________________;若往溶液中加入氨水至中性,则c(Na+)______c(HSO3-) + c(SO32-) + c(H2SO3)(填“>”、“﹤”或“=”)。
(5)往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-)的比值____________(填“变大”、“变小”或“保持不变”)。