题目内容
【题目】实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):

(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用________________(选填装置编号)。请写出生石灰在此反应中的两个作用____________、___________。
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置__________(选填装置编号)中加入____以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为_____________________________。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:______________。
(5)1892年,英国科学家瑞利(( Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大50‰左右。若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:_____________。
【答案】 D CaO与水反应,减少了溶剂 CaO遇水放热,降低了NH3的溶解度(或促使氨水分解) E 碱石灰或CaO或固体氢氧化钠 NaNO2 +NH4Cl== NaCl+ N 2 ↑+2H2O Cu和CuO可以循环使用,节省试剂;避免使用有毒的NaNO2,污染小 方法二制得的氮气中含有密度比氮气大的稀有气体,导致密度偏大
【解析】(1)用CaO和浓氨水反应,应选固+液—不加热型的发生装置,即D;浓氨水常温下跟生石灰反应生成氨气和氢氧化钙,化学方程式为CaO+NH3H2O=NH3↑+Ca(OH)2,因为氨水不稳定易挥发,生石灰和水反应生成熟石灰的过程中,生石灰的两个作用是:一方面CaO与水反应,减少了溶剂水,另一方面CaO遇水放热,降低了NH3的溶解度(或促使氨水分解)。
(2)空气中除了氮气、氧气外,还含有二氧化碳、水蒸气等,为保证所得氨气尽可能纯净,要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过装置E(内装碱性干燥剂-碱石灰或CaO或固体氢氧化钠),既可以吸收二氧化碳又能吸收水。
(3)根据信息反应物是亚硝酸钠(NaNO2)和氯化铵,反应条件是加热,氮元素全部转化为氮气,根据原子守恒,生成物还有氯化钠和水,反应的方程式为:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
(4)由已知,NH3和CuO生成Cu和N2,而将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,故Cu和CuO可以循环使用,节省试剂;方法三使用有毒的亚硝酸钠,方法一和二避免使用有毒的NaNO2,污染小。
(5)方法二将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,只是除去了氧气,其中还含有稀有气体等杂质,由于稀有气体的密度比氮气密度大,所以导致氮气密度总是偏大5‰左右。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案【题目】工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g) + O2(g) ![]() 2SO3(g) + Q
2SO3(g) + Q ![]()
(1)若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
|
| 平衡常数K |
________ | ________ | ________ |
(2)2SO2(g) + O2(g) ![]() 2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
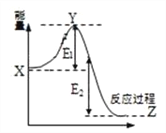
A.加入催化剂,X点位置升高
B.反应热 = E1 + E2
C.反应物总能量低于生成物
D.加入催化剂,E2不变
(3)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
实验1从开始到反应达到化学平衡时,用去时间2分钟,则υ(SO2)表示的反应速率为_________;T1________T2(填“>”、“<”或“=”)。制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
(4)0.1mol/L的NaHSO3溶液中c(H+) > c(OH-),用水解和电离理论的角度解释其原因___________________;若往溶液中加入氨水至中性,则c(Na+)______c(HSO3-) + c(SO32-) + c(H2SO3)(填“>”、“﹤”或“=”)。
(5)往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-)的比值____________(填“变大”、“变小”或“保持不变”)。