题目内容
【题目】某实验小组研究温度对化学反应H2(g)+I2(g)![]() 2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
时间 | 0 | 20 | 40 | 60 | 80 | 100 | |
HI(g)的物质 的量分数 | T1 | 0 | 0.50 | 0.68 | 0.76 | 0.80 | 0.80 |
T2 | 0 | 0.60 | 0.72 | 0.75 | 0.75 | 0.75 | |
下列说法正确的是( )
A.T1温度下,0~20min之间,H2的平均反应速率为0.025mol·L-1·min-1
B.在T1温度下,该反应有可能在70min时已达到平衡状态
C.T2温度下,20min时的正反应速率大于40min时的逆反应速率
D.由表中数据可知,温度越高,H2(g)与I2(g)的反应限度越大
【答案】C
【解析】
T1温度下,80min到100min,HI(g)的物质的量分数不再变化,说明80min时已平衡;
T2温度下,60min到80min,HI(g)的物质的量分数不再变化,说明60min时已平衡。
A.设H2的变化值为xmol,则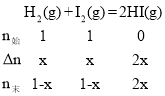 ,T1温度下,20min时,HI(g)的物质的量分数为50%,则50%=
,T1温度下,20min时,HI(g)的物质的量分数为50%,则50%=![]() ,解得:x=0.5,故T1温度下,0~20min之间,v(H2)=
,解得:x=0.5,故T1温度下,0~20min之间,v(H2)=![]() = 0.0125mol·L-1·min-1,A错误;
= 0.0125mol·L-1·min-1,A错误;
B.由表可知,T1温度下,40min到60min,HI(g)的物质的量分数增大0.76-0.68=0.08,平均每10min增大0.04,随着反应的进行,60min到70min,反应速率减小,则60min到70min,HI(g)的物质的量分数增大值小于0.04,即70min,HI(g)的物质的量分数小于0.76+0.04=0.8,故70min时,反应还未平衡,B错误;
C.随着反应的进行,正反应速率减小,故T2温度下,20min时的正反应速率大于40min时的逆反应速率,C正确;
D.T2温度达到平衡的时间比T1温度时短,说明T2>T1,由表可知,T2时H2(g)与I2(g)的反应限度小于T1时H2(g)与I2(g)的反应限度,故温度越高,H2(g)与I2(g)的反应限度越小,D错误。
答案选C。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案