题目内容
【题目】硫酸镍(NiSO4)是电镀镍工业所用的主要镍盐,易溶于水。下图为某兴趣小组设计的在实验室中
制备 NiSO46H2O 的装置。
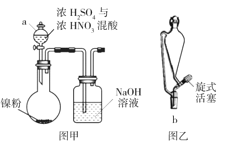
回答下列问题:
(1)实验室中配制浓 H2SO4 与浓 HNO3 混酸的操作为______。
(2)图甲中仪器 a 的名称为__________,有同学认为将仪器 a 换作图乙中的仪器 b 效果更好,其理由 为______。
(3)混酸与镍粉反应时,除生成 NiSO4 外,还生成了 NO2、NO 和 H2O,若 NO2 与 NO 的物质的量之比为 1∶1,则该反应的化学方程式为______。从反应后的溶液中得到 NiSO46H2O 的操作有_____和过滤、洗涤、干燥。
(4)该小组同学查阅资料发现用镍粉与混酸制备 NiSO4 成本高,用冶铁尾矿提取的草酸镍(NiC2O4)与硫酸制取 NiSO4 成本较低。反应原理为:NiC2O4![]() NiO+CO↑+CO2↑,NiO+H2SO4===NiSO4+H2O(已知 PdCl2溶液能够吸收 CO)。现加热 NiC2O4 制备 NiO,并检验生成的 CO,可能用到的装置如下:
NiO+CO↑+CO2↑,NiO+H2SO4===NiSO4+H2O(已知 PdCl2溶液能够吸收 CO)。现加热 NiC2O4 制备 NiO,并检验生成的 CO,可能用到的装置如下:
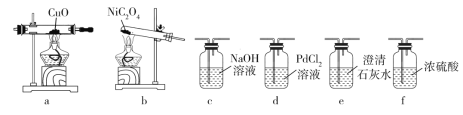
①各装置的连接顺序为:_____→______→_______→ f →_____→_____→_____。(填装置 标号,可重复使用)
②能够说明生成 CO 的现象有______。
③PdCl2 溶液吸收 CO 时产生黑色金属单质和 CO2 气体,该反应其他产物的化学式为______________________。
(5)将 NiSO46H2O 制成电镀液时往往加入少量稀硫酸,其目的是___________________ 。
【答案】将浓H2SO4沿容器壁缓慢倒入浓HNO3中,并不段搅拌 分液漏斗 图乙中仪器的玻璃侧管可以平衡漏斗与圆底烧瓶压强,便于液体顺利流下 2Ni+2H2SO4+2HNO3=2NiSO4+NO2![]() +NO
+NO![]() +3H2O 蒸发浓缩、冷却结晶 b c e a e d a中固体变红,a前的e中石灰水不变浑浊,a后的e中石灰水变浑浊 HCl 抑制Ni2+水解
+3H2O 蒸发浓缩、冷却结晶 b c e a e d a中固体变红,a前的e中石灰水不变浑浊,a后的e中石灰水变浑浊 HCl 抑制Ni2+水解
【解析】
(1)实验室中液体混合时,应该将密度大的液体倒入密度小的液体中;
(2)仪器a为分液漏斗;利用大气压分析仪器 a和仪器 b的优劣;
(3)根据得失电子守恒配平方程式;从溶液中得到结晶水合物需要将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;
(4)①、②先用b装置加热![]() 使其分解,然后用c装置除去
使其分解,然后用c装置除去![]() ,用e装置检验
,用e装置检验![]() 是否除尽,若已除尽,则e中的石灰水不变浑浊,然后用f装置干燥CO,再用干燥的CO在a装置中还原CuO,黑色固体变红,产生的
是否除尽,若已除尽,则e中的石灰水不变浑浊,然后用f装置干燥CO,再用干燥的CO在a装置中还原CuO,黑色固体变红,产生的![]() 使e装置中的石灰水变浑浊,最后用d装置中的
使e装置中的石灰水变浑浊,最后用d装置中的![]() 溶液吸收CO;
溶液吸收CO;
③根据信息,反应的方程式为:![]() ;
;
(5)![]() 易水解,利用平衡移动解释。
易水解,利用平衡移动解释。
(1)实验室中液体混合时,应该将密度大的液体倒入密度小的液体中,浓硫酸密度大,且稀释时放出大量的热,所以要将浓硫酸沿器壁缓慢倒入浓硝酸,并不断搅拌,
故答案为:将浓H2SO4沿容器壁缓慢倒入浓HNO3中,并不段搅拌;
(2)仪器a为分液漏斗;图乙所示乙为恒压漏斗,恒压漏斗的玻璃侧管连通漏斗和圆底烧瓶,可以平衡漏斗与圆底烧瓶的压强,便于液体顺利流下,
故答案为:分液漏斗;图乙中仪器的玻璃侧管可以平衡漏斗与圆底烧瓶压强,便于液体顺利流下;
(3)根据题意,![]() 与
与![]() 的物质的量之比为1:1,均设为1mol,则
的物质的量之比为1:1,均设为1mol,则![]() 共得4mol电子,1mol
共得4mol电子,1mol![]() 失去2mol电子,则需要2mol
失去2mol电子,则需要2mol![]() ,配平可得:
,配平可得:![]() ;从溶液中得到结晶水合物需要将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,
;从溶液中得到结晶水合物需要将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,
故答案为:![]() ;
;
(4)①先用b装置加热![]() 使其分解,然后用c装置除去
使其分解,然后用c装置除去![]() ,用e装置检验
,用e装置检验![]() 是否除尽,若已除尽,则e中的石灰水不变浑浊,然后用f装置干燥CO,再用干燥的CO在a装置中还原CuO,黑色固体变红,产生的
是否除尽,若已除尽,则e中的石灰水不变浑浊,然后用f装置干燥CO,再用干燥的CO在a装置中还原CuO,黑色固体变红,产生的![]() 使e装置中的石灰水变浑浊,最后用d装置中的
使e装置中的石灰水变浑浊,最后用d装置中的![]() 溶液吸收CO,因此连接顺序为b→c→e→f→a→e→d,
溶液吸收CO,因此连接顺序为b→c→e→f→a→e→d,
故答案为:b;c;e; a;e;d;
②由上诉分析可知能够说明生成 CO 的现象有:a中固体变红,a前的e中石灰水不变浑浊,a后的e中石灰水变浑浊,
故答案为:a中固体变红,a前的e中石灰水不变浑浊,a后的e中石灰水变浑浊;
③根据信息,反应的方程式为:![]() ,则另一种产物为HCl,
,则另一种产物为HCl,
故答案为:HCl;
(5)![]() 易水解,抑制
易水解,抑制![]() 水解时不能引入杂质,所以用稀硫酸抑制
水解时不能引入杂质,所以用稀硫酸抑制![]() 水解,
水解,
故答案为:抑制Ni2+水解。

 阅读快车系列答案
阅读快车系列答案