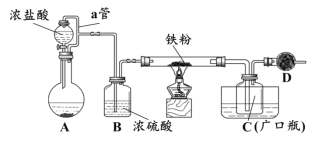
题目内容
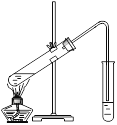
【题目】利用电化学原理还原CO2制取ZnC2O4的装置如图所示(电解液不参加反应),下列说法正确的是

A. 可用H2SO4溶液作电解液
B. 阳离子交換膜的主要作用是増強导电性
C. Pb电极的电极反应式是2CO2-2e-==C2O42-
D. 工作电路中毎流过0.02mol电子,Zn电极质量减重0.65g
【答案】D
【解析】锌在阳极失电子,发生Zn-2e-== Zn2+;Pb电极上二氧化碳得电子发生还原反应:2CO2+2e-==C2O42-;金属锌可以和硫酸反应,离子交换膜允许部分离子通过,根据电极反应式并结合电子守恒来回答问题。
如果用硫酸溶液作电解液,溶液中氢离子会在正极得电子生成氢气,影响2CO2+2e-==C2O42-反应的发生,A错误;用阳离子交換膜把阳极室和阴极室隔开,它具有选择透过性,只允许氢离子透过,其它离子难以透过,B错误;Pb电极为正极,发生还原反应,2CO2+2e-==C2O42-,C错误;锌电极为负极,发生氧化反应,Zn-2e-== Zn2+;当电路中毎流过0.02mol电子,消耗锌的量为0.01mol,质量为0.65g,D正确;正确选项D。

 名校课堂系列答案
名校课堂系列答案【题目】某校化学兴趣小组的同学对含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品有样品、蒸馏水、MgCl2溶液,需要测定的实验数据有__________。
(2)乙同学运用中和滴定法测定样品中NaOH的含量。
①用分析天平准确称取该样品5.0000 g,全部溶于水配制成1000.0 mL溶液。用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应____________________________________。
②用浓度为0.100 0 mol·L-1的盐酸标准溶液进行滴定。开始滴定前的一步操作是________。
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
④滴定过程中,锥形瓶中溶液的pH变化如下:
V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
请在坐标图中绘制出上述中和滴定的曲线。______________

⑤如表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是________。
指示剂 | 变色范围(pH) | 颜色 | |
酸 | 碱 | ||
甲基橙 | 3.1~4.4 | 红 | 黄 |
石蕊 | 5.0~8.0 | 红 | 蓝 |
酚酞 | 8.2~10.0 | 无 | 红 |
⑥样品中,NaOH的质量百分含量为____________。
【题目】十九大报告提出了“积极参与全球环境治理,落实减排承诺”。其中氮的化合物的处理和利用是环境科学研究的热点。
(1)机动车排放的尾气中主要污染物为NOx ,可用 CH4 催化还原 NOx 以消除其污染。298 K时,1.0 g CH4 (g)与足量的NO气体完全反应生成N2、CO2和H2O(g),放出72. 5 kJ的热量。该反应的热化学方程式为_______________。
(2)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
ΔH1、ΔH2、ΔH3之间的关系为ΔH3=___________;K1、K2、K3的关系为K3=____________。
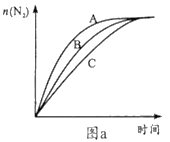
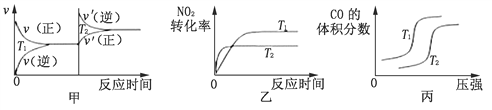
(3)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、NO2等有毒气体转化为无毒气体:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图像正确的是________(填序号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图像正确的是________(填序号)。
(4)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s) +2NO(g)![]() N2(g) + CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g) + CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
① T1℃时,该反应在0~20min的平均反应速率v(CO2)=__________________;该反应的平衡常数K= _____________;
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______(填序号);
A. 加入一定量的活性炭 B. 恒温恒压充入氩气
C. 适当缩小容器的体积 D. 加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则和原平衡相比,NO的转化率_____________(填“升高”或“降低”),ΔH_______0(填“﹥”、“﹤”或“=”)。