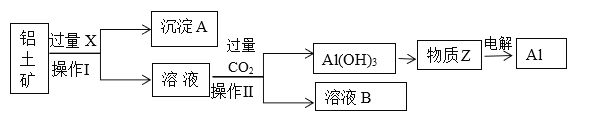
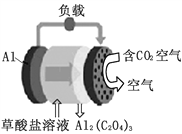
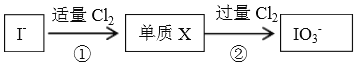
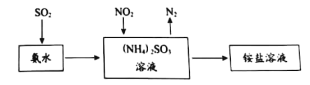
��Ŀ����
����Ŀ��ʮ�Ŵ�����ˡ���������ȫ����������ʵ���ų�ŵ�������е��Ļ�����Ĵ����������ǻ�����ѧ�о����ȵ㡣
��1���������ŷŵ�β������Ҫ��Ⱦ��ΪNOx ������ CH4 ����ԭ NOx ����������Ⱦ��298 Kʱ��1.0 g CH4 (g)��������NO������ȫ��Ӧ����N2��CO2��H2O(g)���ų�72. 5 kJ���������÷�Ӧ���Ȼ�ѧ����ʽΪ_______________��
��2���������������������еĺ�����������û�����NOCl���漰����ط�Ӧ�У�
�Ȼ�ѧ����ʽ | ƽ�ⳣ�� | |
�� | 2NO2(g)+NaCl(s) | K1 |
�� | 4NO2(g)+2NaCl(s) | K2 |
�� | 2NO(g)+Cl2(g) | K3 |
��H1����H2����H3֮��Ĺ�ϵΪ��H3��___________��K1��K2��K3�Ĺ�ϵΪK3��____________��
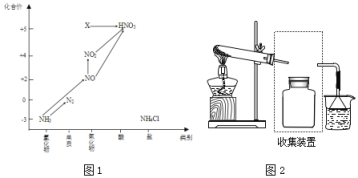
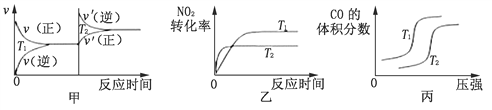
��3����������װβ������װ�ã���ʹ����β���к��е�CO��NO2���ж�����ת��Ϊ�����壺4CO(g)��2NO2(g)![]() 4CO2(g)��N2(g) ��H��-1200 kJ��mol-1�����ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T����������������ͬʱ������ͼ����ȷ����________������ţ���
4CO2(g)��N2(g) ��H��-1200 kJ��mol-1�����ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T����������������ͬʱ������ͼ����ȷ����________������ţ���
��4���û���̿��ԭ��Ҳ���Դ������������ij�ܱ������м���һ�����Ļ���̿��NO��������Ӧ��C(s) +2NO(g)![]() N2(g) + CO2(g) ��H����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g) + CO2(g) ��H����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ��/min Ũ��/mol��L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
�� T1��ʱ���÷�Ӧ��0��20min��ƽ����Ӧ����v(CO2)=__________________���÷�Ӧ��ƽ�ⳣ��K= _____________��
��30min��ֻ�ı�ijһ�����������ϱ��������жϸı������������_______������ţ���
A. ����һ�����Ļ���̿ B. ���º�ѹ�������
C. �ʵ���С��������� D. ������ʵĴ���
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ5:3:3�����ԭƽ����ȣ�NO��ת����_____________������ߡ����͡���,��H_______0�����������������=������
���𰸡� CH4(g)+4NO(g) === 2N2(g)+CO2(g)+2H2O(g) ��H=-1160kJ��mol-1 2��H1-��H2 K12/K2 �� 0.015mol��L-1��min-1 0.56����9/16�� C ���� ��
����������1�����⿼���Ȼ�ѧ��Ӧ����ʽ����д��CH4��NO��Ӧ�ķ���ʽΪCH4��4NO=CO2��2H2O��2N2��16gCH4��Ӧ�ų�������Ϊ16��72.5kJ=1160kJ�����Ȼ�ѧ��Ӧ����ʽΪ CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ��H=-1160kJ��mol��1����2�����⿼���˹���ɺͻ�ѧƽ�ⳣ���ı���ʽ�����ݢ۵ķ�Ӧ��������١�2���ڵó���H3=2��H1����H2����K1= 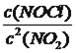 ����K2=
����K2=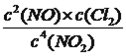 ����K3=
����K3=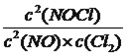 �������K3=K12/K2����3�����⿼��Ӱ�컯ѧ��Ӧ���ʵ����غ���������ԭ�����ף������¶ȣ���ѧ��Ӧ���ʼӿ죬�������¶ȣ����淴Ӧ���ʶ����ʼ״����ң�T2>T1��T2�ȴﵽƽ�⣬����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����NO2��ת���ʽ��ͣ�������ȷ�����������¶ȣ�ƽ�����淴Ӧ�����ƶ���CO������������ʱ�����4�����⿼�黯ѧ��Ӧ���ʵļ��㡢��ѧƽ�ⳣ���ļ��㡢��������ԭ�����ٸ��ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(CO2)=0.30/20mol/(L��min)=0.015mol/(L��min)�����ݱ������ݣ���20min�ﵽƽ�⣬���ݻ�ѧƽ�ⳣ���ı���ʽK=
�������K3=K12/K2����3�����⿼��Ӱ�컯ѧ��Ӧ���ʵ����غ���������ԭ�����ף������¶ȣ���ѧ��Ӧ���ʼӿ죬�������¶ȣ����淴Ӧ���ʶ����ʼ״����ң�T2>T1��T2�ȴﵽƽ�⣬����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����NO2��ת���ʽ��ͣ�������ȷ�����������¶ȣ�ƽ�����淴Ӧ�����ƶ���CO������������ʱ�����4�����⿼�黯ѧ��Ӧ���ʵļ��㡢��ѧƽ�ⳣ���ļ��㡢��������ԭ�����ٸ��ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(CO2)=0.30/20mol/(L��min)=0.015mol/(L��min)�����ݱ������ݣ���20min�ﵽƽ�⣬���ݻ�ѧƽ�ⳣ���ı���ʽK=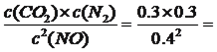 9/16����A���������̿������̿Ϊ���壬�Ի�ѧƽ���ƶ���Ӱ�죬��A����B�����º�ѹ�£�������������������������ֵ�Ũ�Ƚ��ͣ���B����C���ʵ���С�������������ֵ�Ũ������C��ȷ��D��������ʵĴ����������Ի�ѧƽ���ƶ���Ӱ�죬��D���۴�ʱ�Ļ�ѧƽ�ⳣ��Ϊ9/25<9/16����������¶ȣ�NO��ת���ʽ��ͣ�����Ӧ�����Ƿ��ȷ�Ӧ������H<0��
9/16����A���������̿������̿Ϊ���壬�Ի�ѧƽ���ƶ���Ӱ�죬��A����B�����º�ѹ�£�������������������������ֵ�Ũ�Ƚ��ͣ���B����C���ʵ���С�������������ֵ�Ũ������C��ȷ��D��������ʵĴ����������Ի�ѧƽ���ƶ���Ӱ�죬��D���۴�ʱ�Ļ�ѧƽ�ⳣ��Ϊ9/25<9/16����������¶ȣ�NO��ת���ʽ��ͣ�����Ӧ�����Ƿ��ȷ�Ӧ������H<0��

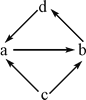
 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�����Ŀ�����и��������У�����֮��ͨ��һ����Ӧ����ʵ��ͼʾ�仯����
���ʱ�� | ����ת����ϵ | a | b | c | d |
�� |
| NO | NO2 | N2 | HNO3 |
�� | Na2O | Na2O2 | Na | NaOH | |
�� | FeCl2 | FeCl3 | Fe | CuCl2 | |
�� | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. �٢ڢ� B. �ۢ�
C. �٢ۢ� D. �ڢ�