题目内容
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
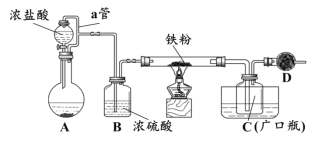
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
【答案】2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 球形干燥管 吸收未反应的Cl2,防止空气中的水进入装置C,使FeCl3潮解 ④ 溶液褪色 36.52 偏高 在AB装置间增加一个装有饱和食盐水的洗气装置,除去Cl2中混有的HCl
【解析】
(1)高锰酸钾与浓盐酸反应生成氯化钾、氯化镁、氯气和水,根据仪器构造判断其名称;
(2)根据氯化铁易吸收空气中的水分而潮解以及氯气有毒分析解答;
(3)根据氯化亚铁具有还原性分析解答;
(4)根据铁元素守恒解答;
(5)根据氯化铁和氯化亚铁中铁元素的质量分数分析判断;根据生成的氯气中含有氯化氢分析解答。
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O。仪器D的名称是球形干燥管。
(2)氯气有毒需要尾气处理,又因为氯化铁易吸收空气中的水分而潮解,所以D中装的药品是碱石灰,其作用是吸收未反应的Cl2,防止空气中的水进入装置C,使FeCl3潮解。
(3)氯化亚铁具有还原性,能使高锰酸钾溶液褪色,因此如果产物中混有FeCl2,可用酸性KMnO4溶液检验,答案选④,实验现象是溶液褪色;
(4)双氧水能把亚铁离子氧化为铁离子,加入氢氧化钠转化为氢氧化铁沉淀,灼烧转化为氧化铁,物质的量是2.4g÷160g/mol=0.015mol,根据铁元素守恒可知铁元素的质量是0.015mol×2×56g/mol=1.68g,则该样品中铁元素的质量分数为1.68g/4.6g×100%≈36.52%;
(5)①由于氯化铁中铁元素的质量分数小于氯化亚铁中铁元素的质量分数,则用题目所给的装置制得的产物中,如果铁元素含量偏高,则说明含有FeCl2杂质。
②由于生成的氯气中含有氯化氢,氯化氢能与铁反应生成氯化亚铁,则若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是在AB装置间增加一个装有饱和食盐水的洗气装置,除去Cl2中混有的HCl。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
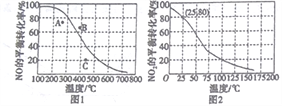
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
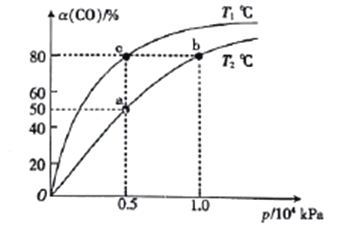
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。