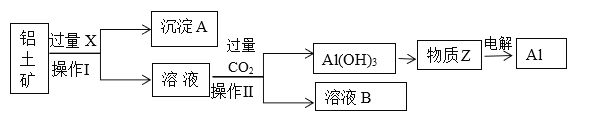
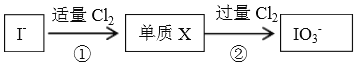
题目内容
【题目】某校化学兴趣小组的同学对含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品有样品、蒸馏水、MgCl2溶液,需要测定的实验数据有__________。
(2)乙同学运用中和滴定法测定样品中NaOH的含量。
①用分析天平准确称取该样品5.0000 g,全部溶于水配制成1000.0 mL溶液。用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应____________________________________。
②用浓度为0.100 0 mol·L-1的盐酸标准溶液进行滴定。开始滴定前的一步操作是________。
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
④滴定过程中,锥形瓶中溶液的pH变化如下:
V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
请在坐标图中绘制出上述中和滴定的曲线。______________

⑤如表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是________。
指示剂 | 变色范围(pH) | 颜色 | |
酸 | 碱 | ||
甲基橙 | 3.1~4.4 | 红 | 黄 |
石蕊 | 5.0~8.0 | 红 | 蓝 |
酚酞 | 8.2~10.0 | 无 | 红 |
⑥样品中,NaOH的质量百分含量为____________。
【答案】 样品质量和加入足量MgCl2溶液后生成的沉淀质量 检漏、润洗 调节盛标准液的滴定管的液面于“0”刻度或“0”刻度以下 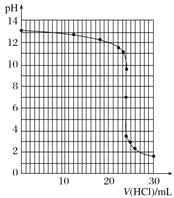 甲基橙或酚酞 96%
甲基橙或酚酞 96%
【解析】(1)甲同学运用沉淀法测定样品中NaOH的含量。根据该同学选用的药品,可以判断其实验原理是:称量一定量的样品,然后溶于水配成溶液,加入足量的MgCl2溶液,测量所生成的沉淀的质量。所以,需要测定的实验数据有:样品质量和加入足量MgCl2溶液后生成的沉淀质量。
(2)①用分析天平准确称取该样品5.0000 g,全部溶于水配制成1000.0 mL溶液。用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应检漏、润洗。
②用浓度为0.100 0 mol·L-1的盐酸标准溶液进行滴定。开始滴定前的一步操作是调节盛标准液的滴定管的液面于“0”刻度或“0”刻度以下。
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
④根据滴定过程中锥形瓶中溶液的pH值,在坐标图中绘制出上述中和滴定的曲线如下: 
⑤根据所作的中和滴定曲线分析,该中和滴定终点的pH=7,根据指示剂的变色范围可知,上述中和滴定中可以选用的指示剂有甲基橙或酚酞。
⑥由题中数据可知,20.00 mL样品溶液消耗了0.100 0 mol·L-1的盐酸24.00mL,所以n(NaOH)=n(HCl)= ![]() 2.4
2.4![]() mol,NaOH的质量百分含量为
mol,NaOH的质量百分含量为 96% 。
96% 。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
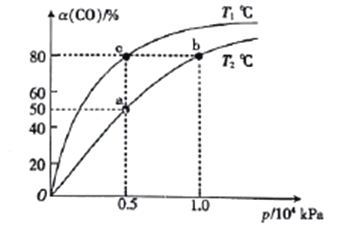
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。