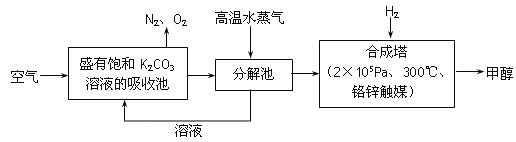
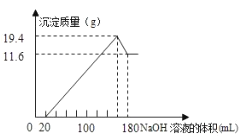
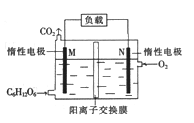
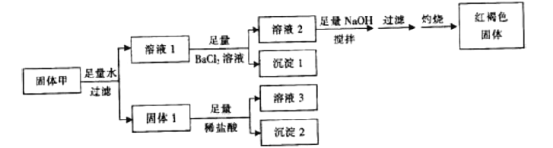
题目内容
【题目】铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是
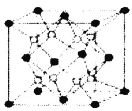
A.铁镁合金的化学式为Mg2Fe
B.晶体中存在的化学键类型为共价键
C.晶格能:氧化镁>氧化钙
D.该晶胞的质量是![]() g(NA表示阿伏加德罗常数的值)
g(NA表示阿伏加德罗常数的值)
【答案】B
【解析】
立方晶胞中:每个顶点的原子被8个晶胞共有,所以晶胞对顶点原子只占![]() 份额;每条棱的原子被4个晶胞共有,所以晶胞对顶点原子只占
份额;每条棱的原子被4个晶胞共有,所以晶胞对顶点原子只占![]() 份额;每个面上的原子被2个晶胞共有,所以晶胞对顶点原子只占
份额;每个面上的原子被2个晶胞共有,所以晶胞对顶点原子只占![]() 份额;内部原子不与其他晶胞分享,完全属于该晶胞;金属晶体是通过金属离子与自由电子间的较强作用(金属键)形成的单质晶体;同主族元素的离子,离子半径越小,对应氧化物的的晶格能越大;
份额;内部原子不与其他晶胞分享,完全属于该晶胞;金属晶体是通过金属离子与自由电子间的较强作用(金属键)形成的单质晶体;同主族元素的离子,离子半径越小,对应氧化物的的晶格能越大;
A、依据均摊规则,晶胞中含有的铁原子个数为8×![]() +6×
+6×![]() =4,含有8个镁原子,故化学式为Mg2Fe,故A正确
=4,含有8个镁原子,故化学式为Mg2Fe,故A正确
B、铁镁合金的晶体中存在的化学键类型为金属键,故B错误;
C、在元素周期表中,镁元素在钙元素的上一周期,故Mg2+半径比Ca2+半径小,氧化镁的晶格能大,故C正确;
D、一个晶胞中含有4个“Mg2Fe”,其质量为![]() ×104g/mol=
×104g/mol=![]() g,故D正确。
g,故D正确。
答案选B。

练习册系列答案
相关题目