题目内容
【题目】将一定质量的镁铝合金投入![]() 一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为
一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为![]() 的
的![]() 溶液,生成的沉淀跟加入的
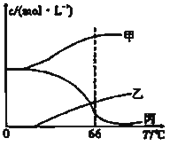
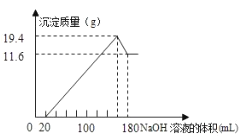
溶液,生成的沉淀跟加入的![]() 溶液的体积关系如图。(横坐标体积单位是
溶液的体积关系如图。(横坐标体积单位是![]() ,纵坐标质量单位是g)求:
,纵坐标质量单位是g)求:
(1)合金中![]() ,
,![]() 的质量_____________
的质量_____________
(2)所用![]() 的物质的量浓度___________
的物质的量浓度___________
【答案】4.8g ;![]()
![]()
【解析】
由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、AI后,盐酸有剩余,此时发生的反应为: HCl+ NaOH= NaCl+ H2O ;继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg (OH) 2和Al (OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应为: Al (OH)3+ NaOH=NaAlO2+2H2O ,据此分析作答;
(1 )由上述分析可知,从加入20mL氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160 mL时,沉淀量最大,此时为Mg (OH) 2和Al (OH)3,该阶段消耗氢氧化钠140 mL ,由氢氧根守恒可知: 3n[Al (OH)3]+2n[Mg (OH) 2]=n ( NaOH)= ( 0.16L-0.02L ) ![]() 5 mol/L=0.7 mol ;从加入氢氧化钠溶液160mL ~ 180mL溶解氢氧化铝,该阶段发生反应: Al (OH)3+ NaOH=NaAlO2+2H2O,所以n[Al (OH)3]= ( 0.18L-0.16L )
5 mol/L=0.7 mol ;从加入氢氧化钠溶液160mL ~ 180mL溶解氢氧化铝,该阶段发生反应: Al (OH)3+ NaOH=NaAlO2+2H2O,所以n[Al (OH)3]= ( 0.18L-0.16L ) ![]() 5mol/L=0.1 mol,由元素守恒规律可知n (Al) =n[Al (OH)3]= 0.1 mol,故Al的质量为:0.1mol
5mol/L=0.1 mol,由元素守恒规律可知n (Al) =n[Al (OH)3]= 0.1 mol,故Al的质量为:0.1mol ![]() 27g/mol= 2.7g;同理可求出n[Mg (OH) 2]=0.2mol ,由元素守恒可知n (Mg) =n[Mg (OH) 2]=0.2mol ,所以Mg的质量为: 0.2mol
27g/mol= 2.7g;同理可求出n[Mg (OH) 2]=0.2mol ,由元素守恒可知n (Mg) =n[Mg (OH) 2]=0.2mol ,所以Mg的质量为: 0.2mol ![]() 24g/mol= 4.8g,故答案为:4.8g、2.7g;
24g/mol= 4.8g,故答案为:4.8g、2.7g;
(2)沉淀量最大,溶液为氯化钠溶液,根据钠元素守恒可知,此时溶液中n ( NaCl) =n ( NaOH) =0.16L![]() 5mol/L=0.8mol ,根据氯离子守恒:n( HCl) =n( NaCl ) =0.mol ,故盐酸的物质的量浓度为:
5mol/L=0.8mol ,根据氯离子守恒:n( HCl) =n( NaCl ) =0.mol ,故盐酸的物质的量浓度为: ![]() =8mol/L,故答案为:
=8mol/L,故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案