题目内容
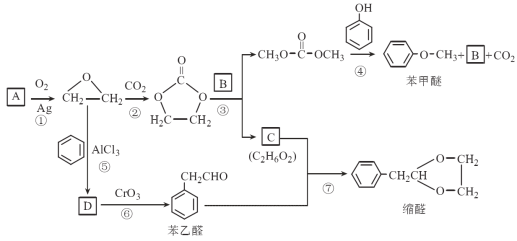
【题目】下图是一种正投入生产的大型蓄电系统,放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
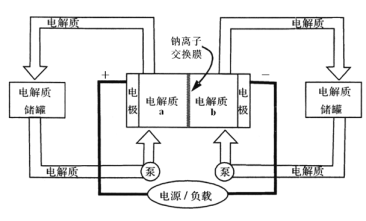
A. 放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-=Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40gNa2S4
【答案】C
【解析】
由题意可知,放电时,负极上Na2S2被氧化为Na2S4,正极上NaBr3被还原为NaBr,则左储罐电解质为NaBr3/NaBr,右储罐电解质为Na2S2/Na2S4。
A、放电时,负极上Na2S2被氧化为Na2S4,电极反应式为:2Na2S2-2e- =Na2S4+2Na+,故A错误;
B、充电时,电池的正极与电源正极相连,作阳极,阳极上NaBr被氧化为NaBr3,电极反应式为:3NaBr-2e-=NaBr3+2Na+,故B错误;
C、放电时,阳离子向正极移动,则离子Na+经过离子交换膜,由b池移向a池,故C正确;
D、没有确定是否为标准状况,无法计算氢气的物质的量,则无法计算b池生成Na2S4质量,故D错误;
答案选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目