题目内容
【题目】为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
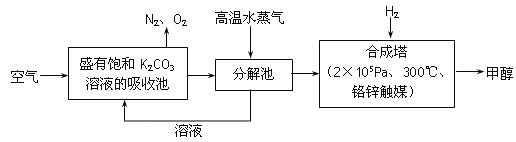
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是______________________________________。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e-=== CO2 + 6H+
则正极发生的反应是__________;放电时,H+移向电池的______(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO32-) (填“>”、“=”或“<”),原因是________________________(用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
【答案】CO2(g)+3H2(g)=== CH3OH(g)+H2O(g)ΔH=-49.47kJ/mol O2+ 4H+ + 4e-=2 H2O 正 4.2×10-7mol·L-1 > 因为既存在 HCO3-![]() CO32-+H+ 也存在HCO3-+H2O
CO32-+H+ 也存在HCO3-+H2O![]() H2CO3+OH-、而HCO3-的水解程度大于电离程度 Ba(OH)2(或NaOH溶液和BaCl2溶液)
H2CO3+OH-、而HCO3-的水解程度大于电离程度 Ba(OH)2(或NaOH溶液和BaCl2溶液)
【解析】
(1)合成塔中发生反应为二氧化碳与氢气反应生成甲醇和水,根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,据此写出反应的热化学方程式;
(2)氧气在正极上被还原,在酸性条件下生成水,由此写出电池正极电极反应式;电池的正极上有聚集的电子,放电时,电解质溶液的阳离子向电池的正极移动;
(3)电离平衡常数指弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度系数次幂的乘积,跟溶液中未电离分子的浓度系数次幂的乘积的比值,则H2CO3HCO3-+H+的平衡常数K= ![]() ;
;
(4)溶液中存在平衡 HCO3-CO32-+H+、HCO3-+H2OH2CO3+OH-,而HCO3-的水解程度大于电离程度;
(5)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全。
(1)根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol;
(2)氧气在正极上被还原,在酸性条件下生成水,电池正极电极反应式为O2+4H++4e-=2H2O,电池的正极上有聚集的电子,放电时,电解质溶液的阳离子向电池的正极移动,即H+移向电池的正极;
故答案为:O2+4H++4e-=2H2O;正;
(3)饱和CO2水溶液的pH=5.6,所以c(H+)=10-5.6=2.5×10-6mol/L,c(H2CO3)=1.5×10-5molL-1,则H2CO3HCO3-+H+的平衡常数,K= ![]() =
=![]() =4.2×10-7molL-1;
=4.2×10-7molL-1;
故答案为:4.2×10-7molL-1;
(4)溶液中存在平衡 HCO3-CO32-+H+、HCO3-+H2OH2CO3+OH-,而HCO3-的水解程度大于电离程度,所以溶液中c(H2CO3)>c(CO32-);
故答案为:>;溶液存在平衡 HCO3-CO32-+H+、HCO3-+H2OH2CO3+OH-,而HCO3-的水解程度大于电离程度;
(5)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全,故可选择Ba(OH)2(或NaOH溶液和BaCl2溶液)作为CO2的沉淀剂;
故答案为:Ba(OH)2(或NaOH溶液和BaCl2溶液)。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案