题目内容
【题目】I.已知:键能指在标准状况下,将 1mol 气态分子 AB(g)解离为气态原子 A(g),B(g)所需的能量,用符号 E 表示,单位为 kJ/mol。N≡N的键能为 946 kJ/mol,H-H 的键能为 436 kJ/mol,N-H 的键能为 391 kJ/mol,则生成 2 mol NH3 过程中______(填“吸收”或“放出”)的能量为______。
II.(1)下列装置属于原电池的是 ______;
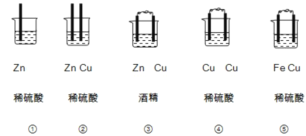
(2)在选出的原电池中,______是负极,发生______反应,正极的现象______;
(3)此原电池反应的化学方程式为______。
(4)将 CH4设计成燃料电池, 其利用率更高, 装置如图所示( A、B 为多孔碳棒), 电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O。
①实验测得 OH-定向移向 B 电极,则_______处电极入口通甲烷(填 A 或 B)。
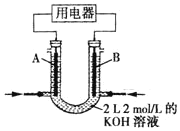
②当消耗甲烷的体积为 33.6L(标准状况下)时,假设电池的能量转化率为 80%,则导线中转移电子的物质的量为_______。
【答案】放出 92kJ ⑤ Fe 氧化 有气泡产生 Fe+H2SO4=FeSO4+H2↑ B 9.6mol
【解析】
Ⅰ.已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为39 1kJ/mol,根据N2 +3H2![]() 2NH3,反应的△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92 kJ/mol,因此生成2molNH3过程中的热量变化为92kJ,该反应为放热反应,故答案为:放出;92kJ;
2NH3,反应的△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92 kJ/mol,因此生成2molNH3过程中的热量变化为92kJ,该反应为放热反应,故答案为:放出;92kJ;
Ⅱ(1)①中没有两个活泼性不同的电极,所以不能构成原电池;
②没有构成闭合回路,所以不能构成原电池;
③酒精为非电解质溶液,所以不能构成原电池;
④两材料相同,所以不能构成原电池;
⑤符合原电池的构成条件,所以能构成原电池;
故答案为:⑤;
(2)该装置中,铁易失电子而作负极,铜作正极,负极上铁失电子发生氧化反应生成亚铁离子,正极上氢离子得电子发生还原反应而生成氢气,所以有气泡生成,故答案为:Fe;氧化;有气泡产生;
(3)该原电池中,负极上铁失电子生成亚铁离子,正极上氢离子得电子生成氢气,所以电池反应式为:Fe+H2SO4=FeSO4+H2↑,故答案为Fe+H2SO4=FeSO4+H2↑;
(4)①实验测得OH-定向移向B电极,原电池中阴离子向负极移动,则B电极是负极,因此B处电极入口通甲烷,故答案为:B;
②负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O,当消耗的甲烷体积为33.6L(标准状况下),则物质的量是1.5mol,假设电池的能量转化率为80%,则导线中转移电子的物质的量为1.5mol×80%×8=9.6mol,故答案为:9.6mol。

【题目】归纳整理是科学学习的重要方法之一。氧族元素的各种性质可归纳整理为如下表所示的表格(部分)。
8O | 16S | 34Se | 52Te | |
单质熔点(℃) | -218.4 | 113 | 450 | |
单质沸点(℃) | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是___________。
(2)碲的化合价可能有__________。
(3)氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生反应的化学方程式为_______________。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:______Al2Te3+______=____Al(OH)3+______H2Te↑