题目内容
【题目】(1)有①![]() 、
、![]() 、
、![]() ;②H2、D2、T2;③石墨、金刚石;④
;②H2、D2、T2;③石墨、金刚石;④![]() 、
、![]() 、
、![]() ;四组微粒或物质。互为同位素的是________(填编号,下同),互为同素异形体的是_________。
;四组微粒或物质。互为同位素的是________(填编号,下同),互为同素异形体的是_________。
(2)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436kJ、946k J、391k J。则由氢气和氮气反应生成1 mol NH3需要__________(填“放出”或“吸收”)___________kJ能量。
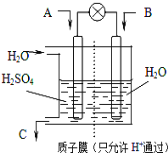
(3)控制和治理SO2是减少酸雨的有效途径,有学者设想以如图所示装置用电化学原理将他们转化为重要化工原料。若A为SO2,B为O2,C为H2SO4。则负极是 ______ (填“A”或“B”),负极反应式为 ______________ 。
(4)已知由甲烷CH4和氧气构成的燃料电池,电解质溶液为KOH溶液时,负极通入的气体为_______,(填化学式),负极反应式为______________
【答案】①④ ③ 放出 46 A ![]() CH4
CH4 ![]()
【解析】
(1)质子数相同中子数不同的同种元素的不同核素之间互称同位素,因此①④中各种微粒之间互称同位素;同种元素构成的结构不同的单质之间互为同素异形体,因此③中的物质之间互为同素异形体;
(2)化学键断裂需要吸收能量,化学键形成需要放出能量,生成1molNH3的过程中化学键断裂吸收的总能量比化学键生成放出的总能量少,所以需要放热,放出的热量为46kJ;
(3)原电池中负极发生的是氧化反应,因此通入SO2的A极为负极,负极电极反应式为:![]() ;
;
(4)燃料电池的负极通入的是燃料(还原剂),因此负极通入的是CH4,负极的反应式为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】归纳整理是科学学习的重要方法之一。氧族元素的各种性质可归纳整理为如下表所示的表格(部分)。
8O | 16S | 34Se | 52Te | |
单质熔点(℃) | -218.4 | 113 | 450 | |
单质沸点(℃) | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是___________。
(2)碲的化合价可能有__________。
(3)氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生反应的化学方程式为_______________。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:______Al2Te3+______=____Al(OH)3+______H2Te↑


