题目内容
在怛容条件下化学反应: 2SO2 ( g ) + O2 ( g )  2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是( )
2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成 lmolSO3固体放热Q/2 kJ
B.2Q1 <2Q2=Q1<Q
C.Ql ="2" Q2= 2Q3 = Q
D.2Q3 < 2Q2 < Q1 < Q
 2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是( )
2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是( )| 容器 | SO2 (mol) | O2(mol) | SO3 (mol) | Q(kJ·mol-1) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
B.2Q1 <2Q2=Q1<Q
C.Ql ="2" Q2= 2Q3 = Q
D.2Q3 < 2Q2 < Q1 < Q

D
反应2SO2 ( g ) + O2 ( g )  2SO3( g ) ;△ H =-QkJ·mol-1的正反应为放热反应,它表示2 mol SO2 ( g )和1 mol O2 ( g )完全反应生成2 mol SO3 ( g )放出Q kJ能量;
2SO3( g ) ;△ H =-QkJ·mol-1的正反应为放热反应,它表示2 mol SO2 ( g )和1 mol O2 ( g )完全反应生成2 mol SO3 ( g )放出Q kJ能量;
由于该反应为可逆反应,所以反应物不能完全转化为生成物,即甲容器反应后放出的热量 ;乙容器的物质的量投入量是甲容器的一半,则放出的热量关系为2Q2 < Q1:对于丙容器,相当于在乙的基础上再加入1 mol SO3 ( g ),平衡将向逆反应方向移动,所以放出的热量关系为Q3 < Q2;所以正确选项为D;
;乙容器的物质的量投入量是甲容器的一半,则放出的热量关系为2Q2 < Q1:对于丙容器,相当于在乙的基础上再加入1 mol SO3 ( g ),平衡将向逆反应方向移动,所以放出的热量关系为Q3 < Q2;所以正确选项为D;
 2SO3( g ) ;△ H =-QkJ·mol-1的正反应为放热反应,它表示2 mol SO2 ( g )和1 mol O2 ( g )完全反应生成2 mol SO3 ( g )放出Q kJ能量;
2SO3( g ) ;△ H =-QkJ·mol-1的正反应为放热反应,它表示2 mol SO2 ( g )和1 mol O2 ( g )完全反应生成2 mol SO3 ( g )放出Q kJ能量;由于该反应为可逆反应,所以反应物不能完全转化为生成物,即甲容器反应后放出的热量
 ;乙容器的物质的量投入量是甲容器的一半,则放出的热量关系为2Q2 < Q1:对于丙容器,相当于在乙的基础上再加入1 mol SO3 ( g ),平衡将向逆反应方向移动,所以放出的热量关系为Q3 < Q2;所以正确选项为D;
;乙容器的物质的量投入量是甲容器的一半,则放出的热量关系为2Q2 < Q1:对于丙容器,相当于在乙的基础上再加入1 mol SO3 ( g ),平衡将向逆反应方向移动,所以放出的热量关系为Q3 < Q2;所以正确选项为D;
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (g) △H=-25 KJ/mol
(g) △H=-25 KJ/mol 
 C(s)=
C(s)= 3.5kJ·mol-1 则2Fe(s)+
3.5kJ·mol-1 则2Fe(s)+
 大于
大于 (
(
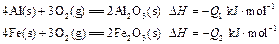

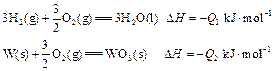
 密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol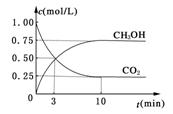
 ΔH=-1277 kJ·mol-1
ΔH=-1277 kJ·mol-1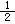 O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1 ,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。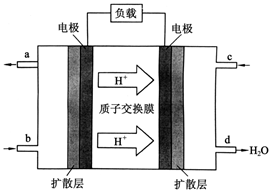

 。
。