(8分) 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
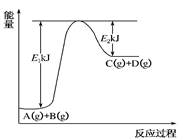
(1)该反应的Δ
H=________kJ·mol
-1(用含
E1、
E2的代数式表示)。(1分)
(2)若在反应体系中加入催化剂使逆反应速率增大,则
E1________(填“增大”、“减小”或“不变”,下同),Δ
H________。(2分)
(3)在相同温度和压强下,对反应A(g)+B(g)??C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| A
| B
| C
| D
|
甲
| a mol
| a mol
| 0
| 0
|
乙
| 2a mol
| a mol
| 0
| 0
|
丙
| a mol
| a mol
| a mol
| a mol
|
丁
| a mol
| 0
| a mol
| a mol
|
上述四种情况达到平衡后,
C(D)的大小顺序是________。(2分)
A.乙=丁>丙=甲 B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。(1分)
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是____(2分)
A.气体平均摩尔质量不再变化 B. 气体压强不再变化
C. 气体密度不再变化 D. 消耗A的速率等于消耗D的速率
E. 各组分浓度之比为1:1:1:1 F. C生成的速率等于B消耗的速率
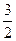 C(s)=
C(s)=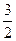 CO2(g)+2Fe(s) △H= +234.1kJ·mol-1 C(s) + O2(g) = CO2(g) △H=-39
CO2(g)+2Fe(s) △H= +234.1kJ·mol-1 C(s) + O2(g) = CO2(g) △H=-39 3.5kJ·mol-1 则2Fe(s)+
3.5kJ·mol-1 则2Fe(s)+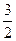 O2(g)= Fe2O3(s)的△H是
O2(g)= Fe2O3(s)的△H是
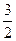 C(s)=
C(s)=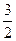 CO2(g)+2Fe(s) △H= +234.1kJ·mol-1 C(s) + O2(g) = CO2(g) △H=-39
CO2(g)+2Fe(s) △H= +234.1kJ·mol-1 C(s) + O2(g) = CO2(g) △H=-39 3.5kJ·mol-1 则2Fe(s)+
3.5kJ·mol-1 则2Fe(s)+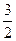 O2(g)= Fe2O3(s)的△H是
O2(g)= Fe2O3(s)的△H是

 阅读快车系列答案
阅读快车系列答案
 化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。  2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是( )
2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是( )
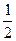 O2(g) = H2O(g) ΔH1=a kJ·mol-1?
O2(g) = H2O(g) ΔH1=a kJ·mol-1? 的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。 __。
__。 2O2(g)=CO2(g) +2H2O(l) △H=-890KJ/mol
2O2(g)=CO2(g) +2H2O(l) △H=-890KJ/mol 共5mol,完全燃烧生成CO2和气态水时,则放出热量(
共5mol,完全燃烧生成CO2和气态水时,则放出热量( Q)的取值范围是 ;若生成CO2和H2O的物质的量相等,则放出的热量是 。
Q)的取值范围是 ;若生成CO2和H2O的物质的量相等,则放出的热量是 。