题目内容
【题目】氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是_______(填标号)。
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为____________。
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g) ![]() 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是____________(填标号)。
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1________T2(填“>”或“<”)。该反应的ΔH______0(填“>”或“<”),判断的依据是_________。
③T2时,HCl的平衡转化率=________,反应的Kx=_____(Kx为以物质的量分数表示的平衡常数)。
【答案】BD H2O2(aq) +2Fe2+(aq) +2H+(aq)=2Fe3+(aq)+2H2O(l) ΔH= (a-b) kJ·mol-1 BD < < T1、T2的平衡体系中气体减少量分别为n(T1)=![]() =0.625mol; n(T2)=
=0.625mol; n(T2)= ![]() =0.5mol,所以T1平衡时转化率更大 50%
=0.5mol,所以T1平衡时转化率更大 50% ![]()
【解析】
(1)①催化剂参与了化学反应,改变了反应历程(生成不同的中间产物),降低了活化能,从而能使化学反应速率加快,但是催化剂的质量和性质不变,反应热不变(只与始终态有关);
②Fe3+作为催化剂,在反应前后质量和性质不变,根据盖斯定律总反应=第一步反应+第二步反应;
(2)①A.催化剂降低了反应的活化能,使反应的速率常数k增大;
B.温度改变瞬间,浓度没有影响,即通过增大k从而改变了速率;
C.从速率方程可知,平衡后分离出水蒸气,降低了c(H2O),使平衡正向移动,从而改变了c(O2)和c(HCl);
D.化学平衡的建立与途径无关,所以“平衡后再充入1molO2和4molHCl”,相当于增大反应体系的压强;
②从图象可知,T2温度下,容器中压强大,达到平衡所需要的时间短,所以温度T2>T1;T1、T2温度下,气体物质的量的减少量分别为n(T1)=5×![]() =0.625mol、n(T2)=5×
=0.625mol、n(T2)=5×![]() =0.5mol,即T1平衡时转化率更大,且因为T2>T1,所以△H<0;
=0.5mol,即T1平衡时转化率更大,且因为T2>T1,所以△H<0;
③对于气相反应,经验平衡常数常见的有Kc、Kp、Kx等,三种平衡常数的表示式相似,只是Kc、Kp、Kx分别用平衡时物质的量浓度、分压、物质的量分数表示。

以此计算HCl的平衡转化率及Kx。
(1)①根据过渡态理论,催化剂参与了化学反应,改变了反应历程(生成不同的中间产物),降低了活化能,从而能使化学反应速率加快,但是催化剂的质量和性质不变,反应热不变(只与始终态有关),BD正确,故答案为:BD;
②Fe3+作为催化剂,在反应前后质量和性质不变,根据盖斯定律总反应=第一步反应+第二步反应,故第二步反应为H2O2(aq)+2Fe2+(aq)+2H+(aq)=2Fe3+(aq)+2H2O(l) △H=(ab)kJmol1,
故答案为:H2O2(aq)+2Fe2+(aq)+2H+(aq)=2Fe3+(aq)+2H2O(l) △H=(ab)kJmol1;
(2)①A.催化剂降低了反应的活化能,使反应的速率常数k增大,根据速率方程v=kca(O2)cb(HCl),反应速率随之增大,A错误;
B. 温度改变瞬间,浓度没有影响,即通过增大k从而改变了速率,使平衡发生移动,故B正确;
C. 从速率方程可知,平衡后分离出水蒸气,降低了c(H2O),使平衡正向移动,从而改变了c(O2)和c(HCl),但对k没有影响,故C错误;
D. 化学平衡的建立与途径无关,所以“平衡后再充入1molO2和4molHCl”,相当于增大反应体系的压强,反应有利于向气体分子数减小的方向进行,故D正确;故答案为:BD;
②从图象可知,T2温度下,容器中压强大,达到平衡所需要的时间短,所以温度T2>T1;T1、T2温度下,气体物质的量的减少量分别为n(T1)=5×![]() =0.625mol、n(T2)=5×
=0.625mol、n(T2)=5×![]() =0.5mol,即T1平衡时转化率更大,且因为T2>T1,所以△H<0,故答案为:<;<;T1、T2的平衡体系中气体减少量分别为n(T1)=5×
=0.5mol,即T1平衡时转化率更大,且因为T2>T1,所以△H<0,故答案为:<;<;T1、T2的平衡体系中气体减少量分别为n(T1)=5×![]() =0.625mol、n(T2)=5×
=0.625mol、n(T2)=5×![]() =0.5mol,所以T1平衡时转化率更大;
=0.5mol,所以T1平衡时转化率更大;
③对于气相反应,经验平衡常数常见的有Kc、Kp、Kx等,三种平衡常数的表示式相似,只是Kc、Kp、Kx分别用平衡时物质的量浓度、分压、物质的量分数表示。

则HCl的平衡转化率为![]() ×100%=50%,
×100%=50%,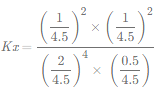 =
=![]() ,故答案为:50%;
,故答案为:50%;![]() 。
。

【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为___。
(2)H2SO4与HClO4中,酸性较强的是___。
(3)NaOH与Al(OH)3中,属于两性氢氧化物的是___。它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为___。