题目内容
【题目】在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系己达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是( )
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.在平衡时体系内N2O4的物质的量为0.25mol
C.在2s时体系内的压强为开始时的1.1倍
D.平衡时,N2O4的转化率为40%
【答案】C
【解析】
A. 2秒时,![]() 的浓度为0.02mol/L,则转化的
的浓度为0.02mol/L,则转化的![]() 浓度为0.01mol/L,则前2秒,以
浓度为0.01mol/L,则前2秒,以![]() 表示的平均反应速度为
表示的平均反应速度为![]() ,故A错误;
,故A错误;
B. 反应进行到60s时,体系已达平衡,此时容器内压强为开始时的1.6倍,设消耗![]() 的物质的量为x,则
的物质的量为x,则
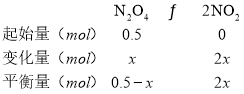
根据压强之比等于物质的量之比![]() ,解得x=0.3mol。在平衡时体系内含
,解得x=0.3mol。在平衡时体系内含![]() 物质的量为
物质的量为![]() ,故B错误;
,故B错误;
C. 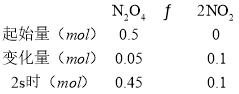
![]() ,在2s时体系内的压强为开始时的1.1倍,故C正确;
,在2s时体系内的压强为开始时的1.1倍,故C正确;
D.平衡时,![]() 的转化率为
的转化率为![]() ,故D错误;
,故D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】下列关于各装置与其对应的实验目的或得到的实验结论的说法中正确的是( )
选项 | A | B | C | D |
实验装置 |
探究温度对平衡2NO2 |
|
|
|
目的或结论 | 探究温度对平衡2NO2 | 试管中收集到无色气体,说明铜与浓硝酸的反应产物是NO | 海带提碘时,用上述装置灼烧海带 | 除去HCl气体中混有的少量Cl2 |
A.AB.BC.CD.D
【题目】(1)BN是一种新型无机材料,由于_________与_________属于等电子体物质,其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似_________的空间网状结构晶体,可用作耐磨材料,另一种是类似于__________的层状结构的混合型晶体,可用作润滑材料,在其结构的每一层上最小的封闭环中有_________个B原子,B—N键角为_________
(2)单质硼有无定形和晶体两种,参考表中数据:
金刚石 | 晶体硅 | 晶体硼 | |
熔点(K) | 3823 | 1683 | 2573 |
沸点(K) | 5100 | 2628 | 2823 |
硬度(M06) | 10 | 7.0 | 9.5 |
①晶体硼的晶体类型属于__________晶体,理由是_______________
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图所示其中20个等边三角形的面和一定数目的顶点,每个顶点上各有1个硼原子。通过观察图形及推算,此基本结构单元由_________个硼原子构成,其中B—B键的键角为___________