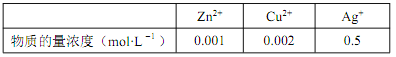
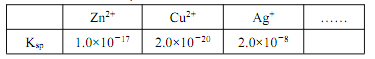题目内容
【题目】常温下,用 0.1000mol·L-1 NaOH溶液滴定 20.00mL0.1000mol·L-1某一元酸HA溶液,滴定曲线如图。下列说法正确的是( )
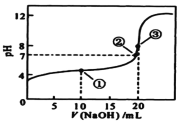
A. HA是强电解质
B. 点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C. 点②所示溶液中:c(Na+) =c(HA) +c(A-)
D. 水的电离程度随着NaOH溶液的滴入,不断增大
【答案】B
【解析】
根据盐类的水解规律及弱电解质的电离平衡分析解答;根据混合溶液中离子浓度的大小比较规律分析解答。
A.根据图象中氢氧化钠溶液体积为0时HA溶液的pH可知,若HA为强酸,0.1mol/L的HA溶液的pH=1,而0.1mol/L的HA溶液的pH一定大于1,故HA为弱酸,即弱电解质,故A错误;
B.①点时,V(NaOH)=10.00mL,HA过量,氢氧化钠被完全反应,发生了中和反应:NaOH+HA=NaA+H2O ,所得溶液中含等物质的量浓度HA和NaA,由于溶液呈酸性,HA的电离程度大于A-的水解程度,故溶液中的离子浓度大小顺序为:c(A-) >c(Na+)>c(H+) >c(OH-),故B正确;
C. 若两者恰好反应生成醋酸钠,溶液显示碱性,则恰好反应时溶液的pH>7,点②pH=7,即c(H+)=c(OH-),说明此时氢氧化钠不足,根据电荷守恒,可得到:c(Na+) +c(H+)=c(OH-) +c(A-),其中,c(H+)=c(OH-),则c(Na+) = c(A-),故C错误;
D. 向HA溶液中滴加NaOH溶液的过程中,在没有完全反应前水的电离程度一直增大,但当NaOH过量后即③点后,随着NaOH的加入,水的电离程度逐渐减小,故D错误。
故选B。

【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
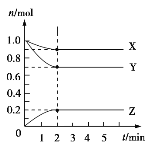
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。