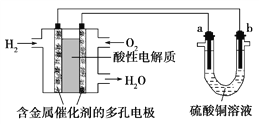
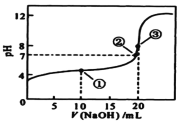
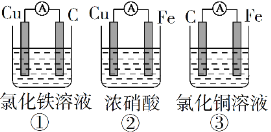
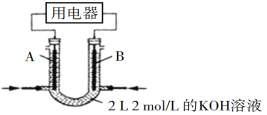
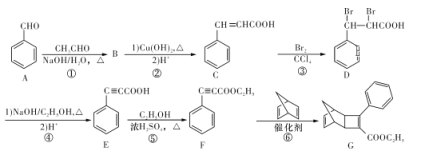
题目内容
【题目】在373 K时,密闭容器中充入一定量的NO2和SO2,发生如下反应:NO2(g)+SO2(g)![]() NO(g)+ SO3(g),平衡时,下列叙述正确的是
NO(g)+ SO3(g),平衡时,下列叙述正确的是
①NO和SO3的物质的量一定相等
②NO2和SO2的物质的量一定相等
③体系中的总物质的量一定等于反应开始时总物质的量
④SO2、NO2、NO、SO3的物质的量一定相等
A. ①和②B. ②和③C. ①和③D. ③和④
【答案】C
【解析】
①充入的是NO2和SO2,又NO和SO3的化学计量数之比为1∶1,其物质的量一定相等;
②充入NO2、SO2的量不知道,平衡时不一定相等;
③反应前后化学计量数之和相等,则总物质的量保持不变;
④充入SO2、NO2的量不确定,则平衡时反应物和生成物的物质的量不一定相等。
故选C。

 名校课堂系列答案
名校课堂系列答案【题目】实验室用50mL0.50molL-1盐酸、50mL0.55molL-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 23.9 |
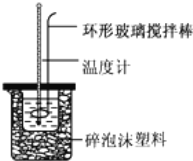
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 _________________ .
(2)在操作正确的前提下,提高中和热测定准确性的关键是 ______ .大烧杯如不盖硬纸板,求得的中和热数值将 ______ (填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在 ______ 中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= ________
[盐酸和NaOH溶液的密度按1gcm-3计算,反应后混合溶液的比热容(c)按4.18J(g℃)-1计算].
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 ______ (填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL0.55molL-1的NaOH溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”或“不相等”),所求中和热 ______ (填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是 __________ .
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
【题目】半导体工业需要高纯硅,粗硅中含有SiO2、Fe2O3、CuO、C等杂质,提纯硅的方法比较多,其中三氯氢硅(有一定毒性)氢还原法和四氯化硅氢还原法应用较为广泛,下面是实验室模拟工业上三氯氢硅氢还原法的基本原理:
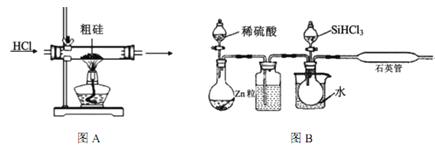
已知:①Si+3HCl ![]() SiHCl3+H2(主要反应)
SiHCl3+H2(主要反应)
Si+4HCl![]() SiCl4+2H2(次要反应)
SiCl4+2H2(次要反应)
2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②典型硅的重要化合物的部分性质如下表:
熔点(℃) | 沸点(℃) | 溶解性 | |
SiHCl3 | -127 | 33 | 易溶于多数有机溶剂 |
SiCl4 | -23 | 77 | 易溶于多数有机溶剂 |
(1)粗硅在提纯前,需要进行酸、碱预处理,其目的是___________________________________。
(2)下列装置在实验室可用于制备HCl气体的是_____(填字母代号)。
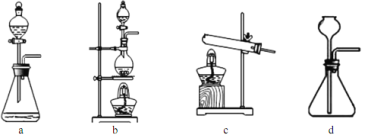
(3)在1100~1200℃条件下,利用图B在石英管中可以获得硅,写出该反应的方程式_______;其烧杯中水的作用是__________________________;该装置使用石英管而不是普通玻璃管的原因是_________。
(4)三氯氢硅氢还原法用 SiHCl3在图B中制硅,不足之处有_______________(任意回答一点即可)。
(5)SiCl4与氢气反应也能得到硅,但反应所需温度不同,在工业上往往将三氯氢硅中混入的SiCl4分离后再与氢气反应,你认为最好的分离方法是______________。
(6)工业上如果用四氯化硅氢还原法制硅,其原理如下:![]() 该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。