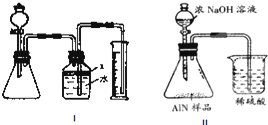
题目内容
3.美丽的“水立方”(Water Cube)是北京奥运会游泳馆,采用膜材料ETFE(四氟乙烯和乙烯的共聚物),为场馆带来更多的自然光.下列说法正确的是( )| A. | ETFE的结构中,存在-CF2-CH2-CF2-CH2-连接方式 | |
| B. | 四氟乙烯与乙烯发生缩聚反应得到ETFE | |
| C. | 以乙烯为原料经过加成反应、取代反应可制得乙二醇 | |
| D. | ETFE材料是热固型(体形结构)的塑料 |
分析 A.根据CF2=CF2、CH2=CH2的链节分别为:-CF2-CF2-、-CH2-CH2-;
B.根据加聚反应无小分子生成,缩聚反应有小分子生成;
C.以乙烯为原料经过加成反应取代反应可制得乙二醇;
D.ETFE是由四氟乙烯和乙烯加聚而成,是线型结构.
解答 解:A.ETFE是由四氟乙烯和乙烯加聚而成,其结构中存在-CF2-CF2-CH2-CH2-的连接方式,故A错误;
B.四氟乙烯与乙烯发生反应得到ETFE,无小分子生成,是加聚反应,不是缩聚反应,故B错误;
C.乙烯与溴水发生加成反应得到1,2-二溴乙烷,1,2-二溴乙烷与NaOH水溶液发生取代反应可制得乙二醇,故C正确;
D.ETFE是由四氟乙烯和乙烯加聚而成,是线型结构,属于热塑型塑料,故D错误;
故选C.
点评 本题主要考查了有机物的性质与反应类型,掌握加聚反应的原理是解题的关键,难度中等.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
10.分子式为C6H12的烃分子有多种异构体,其中主链4个碳原子,只有一个支链的烯烃,下列说法不正确的是( )
| A. | 该烃的名称是2-乙基-1-丁烯 | |
| B. | 该烃与H2加成得到的烷烃的名称是3-甲基戊烷 | |
| C. | 该烃可使溴水褪色,但不能与溴发生取代反应 | |
| D. | 该烃与HCl加成得两种卤代烃 |
11.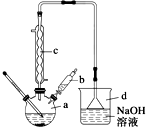 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)仪器d的作用是吸收HBr防污染.
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
8.某有机物结构简式如下: 它的名称为( )
它的名称为( )
 它的名称为( )
它的名称为( )| A. | 3,3-二甲基-2-乙基-戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,3,3-三甲基戊烷 | D. | 3,3,4-三甲基己烷 |


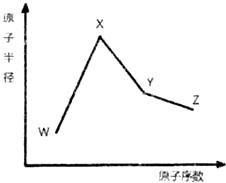 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.