题目内容
16.下列说法正确的是( )| A. | SO2、CaO、CO均为酸性氧化物 | |
| B. | 硫酸钡和水都是弱电解质 | |
| C. | 向煮沸的1mol•L-1 NaOH溶液中滴加饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
分析 A.和碱反应生成盐和水的氧化物为酸性氧化物,和酸反应生成盐和水的氧化物为碱性氧化物,既不能和酸也不能和碱反应的氧化物为不成盐氧化物;
B.在水溶液里或熔融状态下完全电离的是强电解质,部分电离的是弱电解质;
C.NaOH溶液中滴加FeCl3溶液反应生成沉淀;
D.组分不单一,由不同物质组成的为混合物.
解答 解:A.SO2为酸性氧化物,CaO均为碱性氧化物,CO为不成盐氧化物,故A错误;
B.水是弱电解质,强电解质指在水溶液中或熔融状态下,能完全电离,硫酸钡虽在水溶液中很难溶解,但溶于水的部分或熔融状态下,能完全电离BaSO4═Ba2++SO42-,属于强电解质,故B错误;
C.NaOH溶液中滴加FeCl3溶液反应生成沉淀,应向沸水中滴加饱和氯化铁溶液来制备胶体,故C错误;
D.不同物质组成的为混合物,福尔马林为甲醛的水溶液、水玻璃是硅酸钠的水溶液、氨水是氨气的水溶液均为混合物,故D正确;
故选D.
点评 本题考查了物质分类方法和化学概念的实质理解应用以及胶体的制备,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
4.可用于分离或提纯物质的方法有( )
| A. | 过滤 | B. | 加热 | C. | 蒸发 | D. | 洗气 |
11.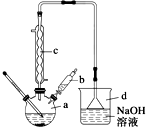 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)仪器d的作用是吸收HBr防污染.
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
8.某有机物结构简式如下: 它的名称为( )
它的名称为( )
 它的名称为( )
它的名称为( )| A. | 3,3-二甲基-2-乙基-戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,3,3-三甲基戊烷 | D. | 3,3,4-三甲基己烷 |
9.如图装置或操作不合理或不能达到实验目的是( )

| A. | 图1装置:存放NaOH溶液 | |
| B. | 图2装置:分离乙酸乙酯和水 | |
| C. | 图3装置:葡萄糖的银镜反应 | |
| D. | 图4装置:配制 100 mL 1 mol/L NaCl溶液 |
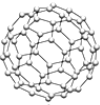 氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料,已知C60中每个碳原子均达到8电子稳定结构.
氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料,已知C60中每个碳原子均达到8电子稳定结构.