题目内容
2.一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24L(标准状况下),则下列情况不可能的是( )| A. | 加入Cu的质量为6.4g | B. | 加入Cu的质量大于6.4g | ||
| C. | 加入浓H2SO4中含溶质为0.2mol | D. | 加入浓H2SO4中含溶质大于0.2mol |
分析 铜粉与浓硫酸混合加热,发生反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,加热条件下,浓硫酸和Cu反应生成二氧化硫但稀硫酸和Cu不反应,以此来解答.
解答 解:铜粉与浓硫酸混合加热,发生反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,加热条件下,浓硫酸和Cu反应生成二氧化硫但稀硫酸和Cu不反应,
A.由反应可知,n(Cu)=n(SO2)=0.1mol,则Cu的质量为0.1mol×64g/mol=6.4g,故A不选;
B.随反应的进行,稀硫酸与Cu不反应,加入Cu的质量可以大于6.4g,故B不选;
C.由反应可知,n(H2SO4)=0.2mol,随反应的进行,稀硫酸与Cu不反应,则加入浓硫酸中溶质应大于0.2mol,故C选;
D.根据C知,加入浓硫酸中溶质应该大于0.2mol,故D不选;
故选C.
点评 本题考查铜和浓硫酸的反应,侧重考查基本计算,明确稀硫酸和铜不反应是解本题关键,根据各个物理量之间的关系式解答即可,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列事实能够证明Al2O3中一定存在离子键的是( )
| A. | 水溶液能导电 | B. | 有较高的熔点 | C. | 熔化时能导电 | D. | 易溶于水 |
10.下列微粒属于等电子体的是( )
| A. | 12CO2和14CO | B. | H2O和NH3 | C. | N2和13CO | D. | NO和CO |
7.下列只含极性键的共价化合物为( )
| A. | KCl | B. | Na2O2 | C. | H2O2 | D. | CH4 |
14.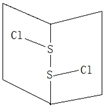 S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )
S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )
 S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )
S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )| A. | 与S2Br2结构相似,熔沸点S2Br2>S2Cl2 | |
| B. | 分子中既含有极性键又含有非极性键 | |
| C. | 与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| D. | 为非极性分子 |
12.有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | D>B>A>C |

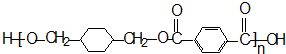
 -CH3+Cl2→
-CH3+Cl2→ -CH2Cl+HCl
-CH2Cl+HCl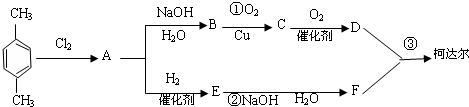
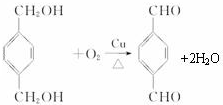
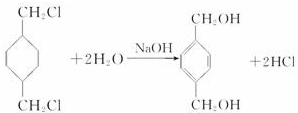
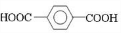 +
+ $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$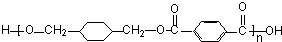 +(2n-1)H2O.
+(2n-1)H2O.